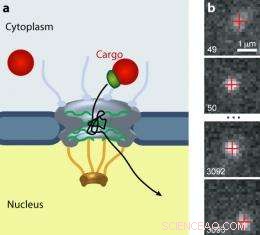
Le complexe de pores nucléaires (NPC) régule le trafic de toutes les molécules entre le cytoplasme et le noyau des cellules eucaryotes. (a) Les cargaisons plus grosses (rouge) nécessitent un récepteur de transport (vert) pour passer la porte. (b) Une cargaison de points quantiques se déplace à travers un PNJ. Image :Alan Lowe
(PhysOrg.com) -- Les chercheurs de l'UC Berkeley Karsten Weis, Jan Liphardt, et ses collègues ont utilisé des sondes fluorescentes appelées points quantiques pour déterminer quelles molécules pénètrent dans le noyau via ses nanopores et lesquelles sont expulsées. Leurs découvertes pourraient aider à concevoir des médicaments capables de traverser les pores et de cibler l'ADN d'une cellule.
Les biophysiciens de QB3 ont tracé avec une résolution sans précédent les chemins des cargaisons se déplaçant à travers le complexe de pores nucléaires (NPC), une ouverture sélective à l'échelle nanométrique qui contrôle l'accès au noyau de la cellule, et répondu à plusieurs questions clés sur sa fonction.
Le PNJ, un gros assemblage de protéines en forme de filet de basket frangé de tentacules, est la porte d'entrée du noyau cellulaire, où sont stockées les informations génétiques. Chaque noyau cellulaire contient environ 2, 000 PNJ, noyée dans l'enveloppe nucléaire. Le NPC (qui mesure environ 50 nanomètres de large) est responsable de tout le transport vers et hors du noyau. Pour éviter que le contenu du reste de l'intérieur de la cellule ne se mélange avec celui du noyau, le PNJ distingue les cargaisons avec une grande précision.
Plusieurs virus ciblent le NPC pour entrer dans le noyau, et le transport dysfonctionnel entre le cytoplasme et le noyau a été impliqué dans plusieurs maladies, y compris le cancer.
Les scientifiques ont construit des modèles pour le PNJ, mais comment ce canal fonctionne et atteint sa sélectivité est resté un mystère. Il est connu que, passer par le PNJ, les grosses molécules doivent se lier à au moins quelques récepteurs appelés « importines »; si la liaison de plus d'importines accélère ou ralentit le passage d'une molécule n'a pas été claire. Donc, trop, a le point exact où une protéine porteuse appelée "Ran" joue un rôle crucial, en remplaçant une molécule de GTP (un carburant cellulaire, un analogue de l'ATP plus connu) pour l'un des GDP que la grosse molécule apporte avec elle lorsqu'elle pénètre dans le NPC.
Karsten Weis, un professeur de biologie moléculaire et cellulaire à l'UC Berkeley, Jan Liphardt, un professeur de physique à l'UC Berkeley, et ses collègues ont mené des expériences d'imagerie avancées qui ont résolu ces problèmes. (Weis et Liphardt sont membres de QB3.) La recherche a été publiée le 1er septembre dans la revue La nature , dans un article sur lequel le post-doctorant de Berkeley Alan Lowe et l'étudiant diplômé Jake Siegel étaient les premiers auteurs conjoints.
Précédemment, les scientifiques avaient observé le mouvement de petites molécules (quelques nm de diamètre), étiqueté avec des étiquettes fluorescentes, via le PNJ. Mais le transit rapide et le faible signal de ces molécules ont entraîné données floues. Lowe, Siegel, et al. employé des « points quantiques », qui ont un diamètre d'environ 20 nm - et donc plus lents que les molécules plus petites - et beaucoup plus brillants que les fluorophores conventionnels. Les chercheurs ont recouvert les points quantiques de signaux reconnus par les importines. En utilisant une technique microscopique qui leur a permis de voir un plat, fine tranche visuelle à travers les cellules vivantes, ils ont regardé des centaines de points individuels entrer, se trémousser dedans, être éjecté de, et dans certains cas admis par, PNJ. Les chercheurs ont enregistré des données vidéo et suivi le mouvement de 849 points quantiques avec une précision nanométrique.
Les chemins en spaghetti des points quantiques, superposées les unes aux autres, a révélé que les particules se répartissaient en trois classes :« avortons précoces, ” qui ont été brièvement confinés puis ont rebondi; « avorte tard, ” qui errait et serpentait jusqu'à l'extrémité intérieure du pore avant de sortir par le chemin par lequel ils sont venus ; et « succès, ” qui a suivi à peu près les mêmes chemins que les avortements tardifs mais a été autorisé à entrer.
Des méandres erratiques des chemins, les chercheurs en ont déduit que les points quantiques diffusaient en effet de manière aléatoire, plutôt que d'être activement transporté. Et l'ajout de plus d'importins au revêtement des points a raccourci le temps de transit, suggérant que les importins rendent la cargaison entrante plus soluble dans le NPC plutôt que de se lier aux murs intérieurs.
Les chercheurs ont trouvé un résultat particulièrement intéressant lorsqu'ils ont retiré la protéine porteuse Ran de l'expérience. Sans Ran dans le mix, les points quantiques suivaient exactement la même gamme de chemins que lorsque Ran était présent, sauf que pratiquement aucun n'est passé par le PNJ.
Compte tenu de leurs données de chemin, les auteurs ont dessiné un modèle de fonctionnement de l'APN. La grande cargaison est initialement capturée par la frange de filaments du PNJ. Il rencontre alors un étranglement, par laquelle il peut entrer dans une sorte d'antichambre. Puis, dans certains cas, Ran échange le PIB de la cargaison contre un GTP et il est admis dans le noyau. Seule la dernière étape est irréversible.
"C'est une étude élégante, " dit Michel Rout, un professeur de biologie cellulaire et structurelle à l'Université Rockefeller dont la spécialité est le transport NPC. "Si nous finissons par comprendre comment le PNJ opère au niveau le plus subtil, nous pourrions peut-être construire des filtres pour sélectionner des molécules d'intérêt."
En effet, l'une des principales nouveautés est que la sélectivité du PNJ semble résulter d'une cascade de filtres, chacun préférant les cargaisons correctes, plutôt qu'une seule étape très sélective. Cela aide à expliquer pourquoi certaines choses peuvent facilement entrer dans le noyau et d'autres sont exclues. Cette découverte peut avoir des implications cliniques très pratiques, Liphardt et Weis disent. Il peut permettre aux scientifiques de développer des techniques pour livrer efficacement de grandes cargaisons artificielles, tels que les conjugués médicament-polymère et les agents de contraste, au noyau, qui contient le génome.