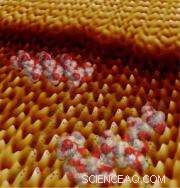
Modèles de peptides et de la structure cristalline de l'oxalate de calcium monohydraté sur une image au microscope à force atomique collectée pendant la croissance cristalline. Le bord inférieur de cette image mesure environ 60 atomes de diamètre. (Image reproduite avec l'aimable autorisation de Jim DeYoreo, et. Al)
(PhysOrg.com) -- Des scientifiques de la fonderie moléculaire de Berkeley Lab ont imagé la croissance de surfaces minérales riches en protéines avec une résolution sans précédent et ont donné un aperçu de la façon dont les systèmes vivants conçoivent des matériaux structurels clés.
Les scientifiques de la fonderie moléculaire du Lawrence Berkeley National Laboratory ont imagé la croissance de surfaces minérales riches en protéines avec une résolution sans précédent, offrant un aperçu des principaux matériaux structurels conçus par les systèmes vivants. La technique haute résolution de l'équipe révèle les mécanismes naturels employés par les créatures en mer comme à terre, et pourrait fournir un moyen d'observer et de diriger cette croissance cristalline au fur et à mesure qu'elle se produit.
Depuis des millions d'années, des organismes, des algues aux humains, ont utilisé la biominéralisation - le processus d'organisation de minéraux tels que le carbonate de calcium en systèmes biologiques - pour générer des coquilles, épines, os et autres matériaux de structure. Récemment, les chercheurs ont commencé à démêler la structure et la composition de ces biominéraux. Cependant, comprendre comment les biomolécules interagissent avec les minéraux pour former ces architectures complexes reste un formidable défi, car il nécessite une résolution au niveau moléculaire et des capacités d'imagerie rapide qui ne perturbent ni ne modifient l'environnement local.
Vidéo :Le film de microscopie à force atomique montre un peptide adsorbé sur une surface cristalline tandis que deux étapes cristallines successives interagissent, puis progresser au-delà du peptide. Le peptide ralentit temporairement l'étape avant de passer à la couche atomique suivante. Le motif en treillis sur la surface correspond à la structure moléculaire du cristal sous-jacent.
Microscopie à force atomique, qui suit des collines et des vallées à l'échelle nanométrique à travers le terrain d'un cristal avec une sonde pointue, est souvent utilisé pour étudier les surfaces. Les déflexions rencontrées par une sonde à travers un matériau sont traduites en signaux électriques puis utilisées pour créer une image de la surface. Cependant, un équilibre minutieux est nécessaire pour maintenir la résolution fournie par une sonde pointue et la flexibilité nécessaire pour ne pas perturber les molécules biologiques molles. Maintenant, Les chercheurs de Molecular Foundry ont développé un outil capable de discerner des matériaux biologiques délicats et de minuscules ondulations à la surface d'un cristal, tout en observant le processus de minéralisation en présence de protéines.
« Nous avons trouvé une approche pour imager de manière cohérente des macromolécules molles sur une surface cristalline dure avec une résolution moléculaire, et nous l'avons fait en solution et à température ambiante, ce qui est beaucoup plus applicable aux milieux naturels, " dit Jim DeYoreo, directeur adjoint de la Fonderie Moléculaire, une installation nationale des utilisateurs du département de l'Énergie des États-Unis située au Berkeley Lab qui fournit un soutien aux chercheurs en nanosciences du monde entier.
« Avec ces sondes hybrides, nous pouvons littéralement regarder les biomolécules interagir avec la surface d'un cristal alors que le cristal croît d'un pas atomique à la fois. Personne n'a pu observer ce processus avec ce genre de résolution jusqu'à présent, " dit Raymond Friddle, chercheur post-doctoral au Lawrence Berkeley National Laboratory.
DeYoreo, Frigo, co-auteurs Matt Weaver et Roger Qiu (Lawrence Livermore National Laboratory), Bill Casey (Université de Californie, Davis) et Andrzej Wierzbicki (Université du sud de l'Alabama), ont utilisé ces sondes de microscope à force atomique « hybride » pour étudier les interactions entre un cristal en croissance d'oxalate de calcium monohydraté, un minéral présent dans les calculs rénaux humains, et des peptides, molécules polymères qui remplissent des fonctions métaboliques dans les cellules vivantes. Ces sondes hybrides allient finesse et flexibilité, ce qui est crucial pour atteindre la vitesse et la résolution requises pour surveiller le cristal en croissance avec une perturbation minimale des peptides.
Les conclusions de l'équipe révèlent un processus complexe. Sur une facette chargée positivement d'oxalate de calcium monohydraté, les peptides forment un film qui agit comme un interrupteur pour activer ou désactiver la croissance cristalline. Cependant, sur une facette chargée négativement, les peptides se bousculent à la surface pour créer des amas qui ralentissent ou accélèrent la croissance cristalline.
"Nos résultats montrent que les effets des peptides sur un cristal en croissance sont beaucoup plus compliqués qu'avec un cristal plus simple, petites molécules. Les formes des peptides en solution ont tendance à fluctuer, et selon les conditions, les processus complexes par lesquels les peptides adhèrent aux surfaces leur permettent de contrôler la croissance cristalline comme un ensemble de « commutateurs », accélérateurs et freins », ", dit Friddle. « Ils peuvent ralentir ou accélérer la croissance, ou même l'activer ou le désactiver brutalement avec de petits changements dans les conditions de la solution. »
L'équipe prévoit d'utiliser sa nouvelle approche pour étudier la physique fondamentale des surfaces cristallines dans les solutions et approfondir sa compréhension de la façon dont les biomolécules et les cristaux interagissent. « Nous pensons que ces résultats jetteront les bases d'un meilleur contrôle des cristaux technologiques, approches biomimétiques de la synthèse de matériaux, et des thérapies potentielles pour les pathologies des tissus durs, », ajoute DeYoreo.