Crédit :Pavel Odinev / Skoltech
Des scientifiques des États-Unis, La Chine et la Russie ont décrit la structure et les propriétés d'un nouvel hydrate de clathrate d'hydrogène qui se forme à température ambiante et à une pression relativement basse. Les hydrates d'hydrogène sont une solution potentielle pour le stockage et le transport de l'hydrogène, le carburant le plus écologique. La recherche a été publiée dans la revue Lettres d'examen physique .
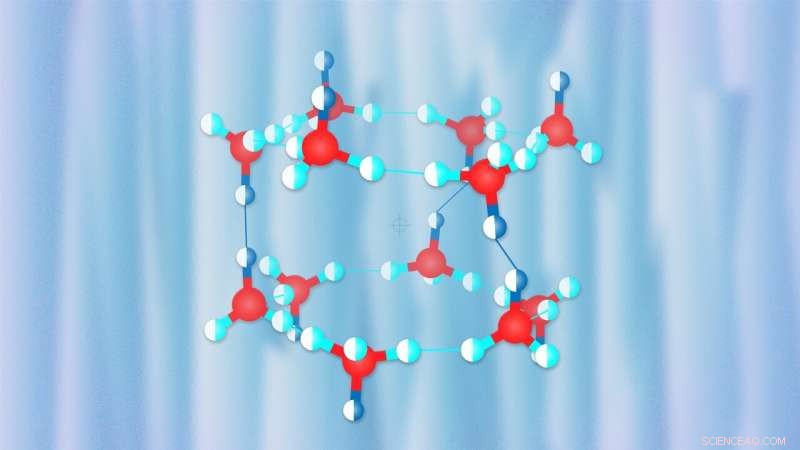
La glace est une substance très complexe qui présente de multiples modifications polymorphes dont le nombre ne cesse de croître à mesure que les scientifiques font de nouvelles découvertes. Les propriétés physiques de la glace varient considérablement, aussi :par exemple, les liaisons hydrogène deviennent symétriques à haute pression, rendant impossible la distinction d'une seule molécule d'eau, alors que les basses pressions provoquent un désordre des protons, placer les molécules d'eau dans de nombreuses orientations spatiales possibles au sein de la structure cristalline. Glace autour de nous, y compris les flocons de neige, est toujours désordonné par les protons. La glace peut incorporer du xénon, chlore, molécules de dioxyde de carbone ou de méthane et forment des hydrates de gaz qui ont souvent une structure différente de la glace pure. La grande majorité du gaz naturel de la Terre existe sous forme d'hydrates de gaz.
Dans leur nouvelle étude, chimistes des États-Unis, La Chine et la Russie se sont concentrées sur les hydrates d'hydrogène. Les hydrates de gaz présentent un grand intérêt tant pour la recherche théorique que pour les applications pratiques, comme le stockage d'hydrogène. S'il est stocké sous sa forme naturelle, l'hydrogène présente un risque d'explosion, alors que la densité est bien trop faible même dans l'hydrogène comprimé. C'est pourquoi les scientifiques recherchent des solutions de stockage d'hydrogène rentables.
"Ce n'est pas la première fois que nous nous tournons vers les hydrates d'hydrogène. Dans nos recherches précédentes, nous avons prédit un nouvel hydrate d'hydrogène avec 2 molécules d'hydrogène par molécule d'eau. Malheureusement, cet hydrate exceptionnel ne peut exister qu'à des pressions supérieures à 380, 000 atmosphères, ce qui est facile à réaliser en laboratoire, mais est difficilement utilisable dans des applications pratiques. Notre nouvel article décrit des hydrates qui contiennent moins d'hydrogène mais peuvent exister à des pressions beaucoup plus basses, ", explique Artem R. Oganov, professeur de Skoltech.
La structure cristalline des hydrates d'hydrogène dépend fortement de la pression. A basse pression, il a de grandes cavités qui, selon Oganov, ressemblent à des lanternes chinoises, chacune hébergeant des molécules d'hydrogène. Au fur et à mesure que la pression augmente, la structure se densifie, avec plus de molécules d'hydrogène emballées dans la structure cristalline, bien que leurs degrés de liberté deviennent beaucoup moins nombreux.
Dans leurs recherches publiées dans le Lettres d'examen physique , les scientifiques de la Carnegie Institution de Washington (États-Unis) et de l'Institute of Solid State Physics de Hefei (Chine) dirigé par Alexander F. Goncharov, professeur dans ces deux institutions, effectué des expériences pour étudier les propriétés de divers hydrates d'hydrogène et a découvert un hydrate inhabituel avec 3 molécules d'eau par molécule d'hydrogène. L'équipe dirigée par le professeur Oganov a utilisé l'algorithme évolutif USPEX développé par Oganov et ses étudiants pour découvrir la structure du composé responsable de son comportement particulier. Les chercheurs ont simulé les conditions utilisées dans l'expérience et ont trouvé une nouvelle structure très similaire à l'hydrate C1 ordonné par les protons connu, mais différant de C1 dans l'orientation des molécules d'eau. L'équipe a montré que le désordre du proton devrait se produire à température ambiante, expliquant ainsi les données de diffraction des rayons X et de spectre Raman obtenues dans l'expérience.