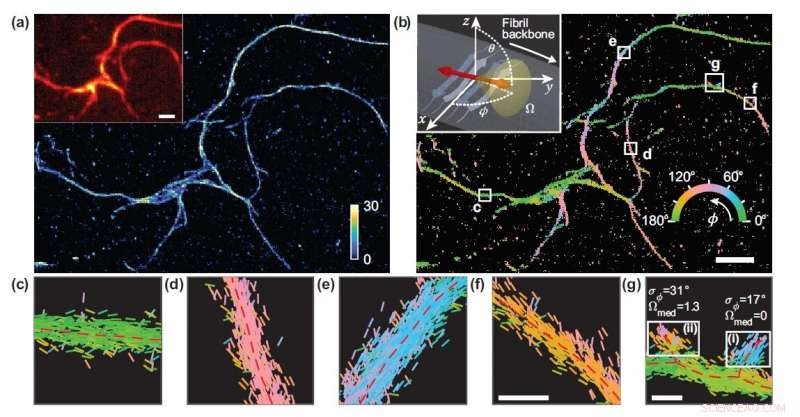
Les chercheurs ont développé une technique de microscopie qui mesure l'emplacement et l'orientation de molécules uniques et l'ont utilisée pour étudier les détails structurels des agrégats de protéines amyloïdes. (a) Image de microscopie de localisation d'une molécule unique d'un réseau d'agrégats amyloïdes. (b) Image montrant les orientations de liaison du rouge du Nil aux surfaces amyloïdes, codés par couleur selon l'orientation moyenne mesurée dans chaque bac. (c-g) Mesures d'orientation individuelles localisées le long des squelettes fibrillaires dans les cases blanches en (b). Les lignes sont orientées et codées par couleur selon la direction de l'angle estimé. Les barres d'échelle blanches horizontales sont des marqueurs de longueur, 1 micron dans (a), (b) et 100 nm dans (f), (g). Crédit :Tianben Ding, Tingting Wu et Matthew D. Lew, Université de Washington à Saint-Louis
Les maladies neurodégénératives telles que la maladie d'Alzheimer et la maladie de Parkinson sont souvent accompagnées de protéines amyloïdes dans le cerveau qui se sont agglutinées ou mal repliées. Une technique nouvellement développée qui mesure l'orientation de molécules individuelles permet d'utiliser la microscopie optique, pour la première fois, pour révéler des détails à l'échelle nanométrique sur les structures de ces protéines problématiques.
Des chercheurs de l'Université de Washington à St. Louis décrivent leur nouvelle approche en Optique , Le journal de la Société d'optique.
"Les maladies neurodégénératives telles que les maladies d'Alzheimer et de Parkinson sont les principales causes de décès dans le monde, " dit Tianben Ding, co-premier auteur du nouvel article. "Nous espérons que notre approche d'imagerie d'orientation de molécule unique peut fournir de nouvelles informations sur la structure amyloïde et peut-être contribuer au développement futur de traitements efficaces contre ces maladies."
Les processus biologiques et chimiques dans le cerveau sont entraînés par des mouvements et des interactions complexes entre les molécules. Bien que la plupart des protéines amyloïdes puissent être non toxiques, le mauvais repliement de quelques-uns pourrait éventuellement tuer de nombreux neurones.
"Nous avons besoin de technologies d'imagerie capables de surveiller ces mouvements moléculaires dans les systèmes vivants pour comprendre les mécanismes biologiques fondamentaux de la maladie, " a expliqué Matthew D. Lew, chef de l'équipe de recherche. "Les maladies amyloïdes et à prions comme la maladie d'Alzheimer, La maladie de Parkinson et le diabète sont nos premières cibles pour cette technologie, mais nous le voyons également appliqué dans de nombreux autres domaines."
Choisir le meilleur microscope
Le laboratoire de Lew a développé plusieurs méthodes de microscopie à super-résolution à molécule unique qui mesurent l'orientation et l'emplacement des molécules fluorescentes attachées à des protéines uniques. Les informations d'orientation sont obtenues en mesurant non seulement l'emplacement de la fluorescence dans l'échantillon, mais également les caractéristiques de cette lumière, comme la polarisation, qui sont généralement ignorés dans la plupart des autres approches de microscopie.
Dans leurs Optique article, les chercheurs ont décrit une mesure de performance qu'ils ont conçue pour caractériser avec quelle sensibilité divers microscopes peuvent mesurer les orientations des molécules fluorescentes. En utilisant le nouvel indicateur de performance, les chercheurs ont découvert qu'un microscope qui divise la lumière de fluorescence en deux canaux de polarisation (x et y) fournit des mesures d'orientation supérieures et pratiques.
"La métrique que nous avons développée calcule les performances d'une conception de microscope particulière 1, 000 fois plus rapide qu'avant, " dit Tingting Wu, co-premier auteur de l'ouvrage. "En mesurant les orientations de molécules isolées liées à des agrégats amyloïdes, le microscope sélectionné nous a permis de cartographier les différences dans l'organisation de la structure amyloïde qui ne peuvent pas être détectées par les microscopes de localisation standard."
Puisqu'il n'y a pas de lien artificiel entre les sondes fluorescentes et les surfaces amyloïdes, l'orientation de liaison des sondes aux surfaces amyloïdes transmet des informations sur la façon dont la protéine amyloïde elle-même est organisée. Les chercheurs ont quantifié comment les orientations des molécules fluorescentes variaient à chaque fois qu'elles étaient attachées à une protéine amyloïde. Les différences dans ces comportements de liaison peuvent être attribuées à des différences de structure entre les agrégats amyloïdes. Étant donné que la méthode fournit des informations sur une molécule unique, les chercheurs ont pu observer des différences à l'échelle nanométrique entre les structures amyloïdes sans faire la moyenne des détails des caractéristiques locales.
Possibilités d'études à long terme
« Nous prévoyons d'étendre la méthode pour surveiller les changements à l'échelle nanométrique au sein et entre les structures amyloïdes à mesure qu'elles s'organisent sur des heures ou des jours, " a déclaré Ding. " Des études à long terme sur les agrégats amyloïdes peuvent révéler de nouvelles corrélations entre la façon dont les protéines amyloïdes sont organisées et la vitesse à laquelle elles se développent ou se dissolvent spontanément. "
Les chercheurs notent que la configuration qu'ils ont utilisée pour la microscopie d'orientation-localisation se composait de pièces disponibles dans le commerce et accessibles à toute personne réalisant une microscopie à super-résolution à molécule unique. Leur code d'analyse est disponible sur https://github.com/Lew-Lab/RoSE-O.
« En microscopie optique et en imagerie, les scientifiques et les ingénieurs ont repoussé les limites de l'imagerie pour être plus rapide, sonde plus profondément et a une résolution plus élevée, " a déclaré Lew. "Nos travaux montrent que l'on peut faire la lumière sur les processus fondamentaux de la biologie par, au lieu, en se concentrant sur l'orientation moléculaire, qui peut révéler des détails sur le fonctionnement interne de la biologie qui ne peuvent pas être visualisés par la microscopie traditionnelle."