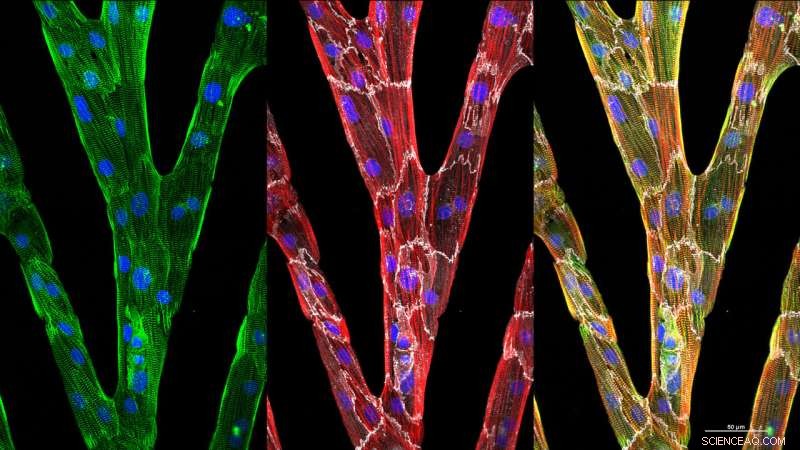
Les trois images montrent des cellules cardiaques individuelles (décrites en blanc) qui ont allongé et aligné leur structure cytosquelettique interne lorsqu'elles sont cultivées dans des voies à micromotifs. L'ajout de ponts entre les voies entraîne une contraction synchronisée sur une grande zone 2D. Crédit :Brett N. Napiwocki
Les maladies cardiaques sont la principale cause de décès aux États-Unis et dans d'autres pays industrialisés, et de nombreux patients font face à des options de traitement limitées. Heureusement, la biologie des cellules souches a permis aux chercheurs de produire un grand nombre de cardiomyocytes, les cellules qui composent le cœur ou le muscle cardiaque et qui ont le potentiel d'être utilisées dans des criblages de médicaments avancés et des thérapies cellulaires.
L'un des pièges de ces cardiomyocytes générés par des cellules souches est qu'ils ne représentent pas des cardiomyocytes humains adultes mais restent immatures sans autre intervention. En outre, les techniques actuelles d'analyse d'images ne permettent pas aux chercheurs d'analyser des images hétérogènes, multidirectionnel, myofibrilles striées typiques des cellules immatures pour déterminer quand de nouvelles interventions poussent les cellules à s'organiser.
Dans le Journal de physique appliquée , les chercheurs présentent un algorithme qui combine des méthodes de gradient avec des transformées de Fourier rapides, la transformation de Fourier à gradient de balayage ou technique SGFT, quantifier les structures des myofibrilles dans les cellules cardiaques avec une précision considérable. Les myofibrilles sont l'unité contractile allongée d'une cellule musculaire.
"Si vous regardez le tissu cardiaque humain adulte, tout n'est pas parfaitement aligné. Tout n'est pas empilé bien et proprement comme une étagère, " a déclaré Wendy Crone, un auteur de l'article. « Les structures sont plus compliquées. Nous voulions pouvoir quantifier l'organisation.
Ce niveau d'analyse, combiné avec de nouvelles études émergentes sur les effets de la mutation cellulaire, a le potentiel de produire de nouvelles connaissances sur les mécanismes sous-jacents à la génération de myofibrilles et de diverses cardiomyopathies, ce qui rend plus difficile pour le muscle cardiaque de pomper le sang vers le reste du corps.
"Il y a un désordre myofibril dans certaines maladies du cœur, " dit Crone. " Avec notre technique, on peut quantifier le désarroi, qui fournit une meilleure compréhension de la gravité de la maladie dans les cellules cardiaques. »
L'hétérogène, les motifs striés que cette nouvelle méthode peut détecter et quantifier se produisent dans d'innombrables autres cas en biologie et ailleurs. Par exemple, la technique SGFT détecte clairement la distribution de l'organisation et de l'orientation du collagène dans les biopsies du tissu mammaire, ce qui est important car le tissu mammaire cancéreux a des structures de collagène plus organisées. Comme des études antérieures l'ont montré, la morphologie des fibres de collagène dans les tissus du cancer du sein est un indicateur pronostique fort de la malignité de la tumeur.
La technique SGFT pourrait également être utilisée pour quantifier des motifs striés dans les neurones à un stade précoce dérivés de cellules souches.
"Notre code peut quantifier l'organisation des rosettes neurales, trop, " dit Crone.