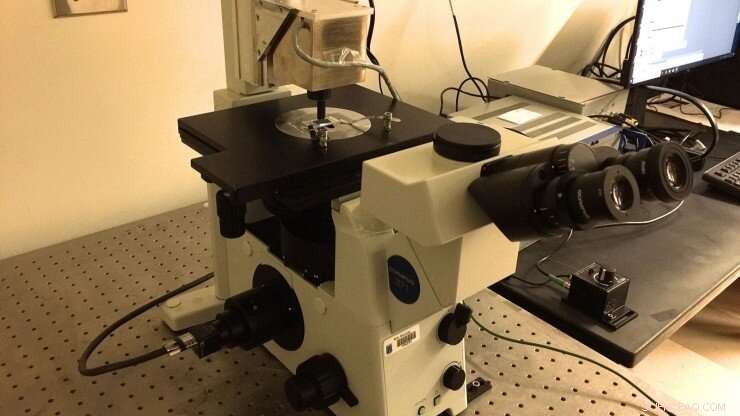
La nouvelle configuration de pincettes magnétiques du laboratoire Marszalek, qui a été construit selon les spécifications partagées par le professeur Julio Fernandez (Columbia University). Une chambre microfluidique fonctionnalisée avec des « brosses » polyprotéiques est imagée à l'aide d'un objectif à huile à immersion qui alimente une caméra CMOS. Des billes magnétiques sont attachées aux polyprotéines afin d'exercer sur elles des forces piconewton en ajustant la position des aimants permanents en néodyme 52. Les aimants sont manipulés à l'aide d'un dispositif PID positionné au-dessus de la chambre. Crédit :Université Duke
En termes d'organisation spatiale, L'ADN a des pouvoirs rivalisant avec Marie Kondo. Un brin d'ADN de deux mètres de long se replie de manière complexe en un noyau cellulaire de seulement 10 microns de diamètre. (Un des cheveux de votre tête a un diamètre de 100 microns, et vous ne pouvez rien voir de plus petit que cela sans microscope.) Tout ce qui doit se produire biochimiquement pour que l'ADN fonctionne dépend du déballage et du déroulement précis de ses brins à partir de ce petit espace.
Mais l'étude de l'ADN et d'autres molécules complexes se concentre souvent non sur leurs propriétés mécaniques mais sur leurs processus chimiques, a noté Piotr Marszalek, professeur de génie mécanique et de science des matériaux de Duke. Alors que la recherche biochimique a conduit à des applications révolutionnaires comme le clonage, thérapie génique et profilage d'expression génique, Marszalek a déclaré que l'intense concentration sur un seul domaine a parfois éclipsé l'importance de la mécanique dans la compréhension de la relation entre la structure moléculaire et la fonction.
Marszalek appartient à une communauté de chercheurs utilisant la spectroscopie de force à molécule unique (SMFS) pour étudier la structure moléculaire, et les forces qui stabilisent ces structures. Actuellement, il existe trois approches principales de SMFS :la microscopie à force atomique (AFM), qui balaye la surface d'une molécule avec une sonde de la taille de quelques atomes et est capable d'étirer mécaniquement ces molécules; pince à épiler optique, qui attirent les particules via des lasers focalisés (et qui ont valu à leur inventeur, Arthur Ashkin, un prix Nobel de physique); et des pincettes magnétiques, dont le tirage est si puissant que Marszalek m'a mis en garde contre les manipuler, de peur que ma peau ne soit pincée entre les cylindres magnétiques et que je les trouve impossible à séparer.
Chaque approche permet aux chercheurs de capturer une seule molécule, comme l'ADN, ou un peu de muscle ou d'une autre protéine - et étirez-le lentement pour observer ce qui se passe.
Il ne se contente pas de se casser en deux, comme on peut s'y attendre.
Les chaînes polypeptidiques sont repliées localement, Marszalek a expliqué, d'une manière qui forme de petits globules. "Lorsque vous étirez initialement une protéine, tu fais une structure droite, " dit-il. " Mais quand vous tirez plus loin, tout commence à se dérouler. Vous pouvez tirer et tirer sans casser, et dans les cas extrêmes, un domaine peut s'effilocher et offrir une longueur supplémentaire pour se protéger."
Marszalek a souligné que ce n'est pas une nouvelle - en mai 1997, trois articles sur ce sujet ont été publiés presque simultanément, un dans La nature (l'équipe de Robert Simmons a utilisé des pincettes optiques) et deux en Science (L'équipe de Carlos Bustamante a également utilisé des pincettes optiques, tandis que l'équipe d'Herman Gaub utilisait l'AFM). Mais ces découvertes ont beaucoup appris aux chercheurs sur la construction musculaire, et renforcent l'importance de comprendre la mécanique à la plus petite échelle.
Marszalek travaille actuellement à comprendre comment les molécules retrouvent leur forme et leur fonction une fois que la tension qui s'exerce sur elles est relâchée. Prenez de la luciférase de luciole - lorsqu'elle est correctement pliée, cette protéine est bioluminescente. Quand il perd sa structure, il devient un simple polymère, incapable de produire de la lumière. D'autres protéines, au même point d'effondrement, bénéficier de l'assistance des "enzymes chaperons" qui aident à retrouver leur forme d'origine. Comment ils le font, exactement, n'est pas clair, et en apprendre davantage sur ce mécanisme pourrait donner un aperçu de la façon dont notre corps guérit après un stress physique.
Certains des collègues de Marszalek étudient les mécanismes des infections bactériennes – comment les bactéries comme le staphylocoque sont capables de détecter les protéines réceptrices dans les cellules et de s'y accrocher avec une telle ténacité que la circulation sanguine est incapable de les éliminer. La force de cette liaison a été mesurée avec succès en 2017 à l'aide de l'AFM, et découvrir comment dissoudre les liens pourrait aider à lutter contre ces infections mortelles.
A la fin de l'été 2019, la National Science Foundation a financé un atelier SMFS organisé par Marszalek, aux côtés d'Andres F. Oberhauser de l'Université du Texas Medical Branch. Tenu à Duke, l'atelier a réuni les sommités qui ont été les pionniers des techniques SMFS il y a des décennies avec des chercheurs juniors se concentrant sur les perspectives d'avenir de la spectroscopie de force. L'ordre du jour intense des sessions et des tables rondes a duré jusque tard dans la soirée chaque jour, au fur et à mesure que les participants ont couvert les principales réalisations permises par chaque technique, orientations futures proposées, et ruminé sur les barrages routiers qui entravent de nouveaux progrès.
C'était aussi, comme Marszalek l'avait espéré, une rencontre d'échange pour des outils et des idées. Des chercheurs de l'Université du Colorado-Boulder ont proposé des molécules pouvant être utilisées comme « poignées » pour séparer d'autres molécules ; un chercheur de Johns Hopkins a démontré comment des pincettes laser peuvent être utilisées pour capturer des protéines fraîchement synthétisées. Marszalek lui-même est reparti avec une nouvelle collaboration brillante avec l'Université de Milwaukee, dont les physiciens ont une expertise approfondie des pincettes magnétiques.
"La spectroscopie de force à molécule unique est clairement arrivée à maturité et a produit de nombreuses découvertes fondatrices dans les domaines de la mécanobiologie et de la mécanochimie, " a déclaré Marszalek. " L'engouement pour les approches SMFS augmente régulièrement, mais il y a des défis à résoudre, en particulier lorsqu'il s'agit d'exploiter SMFS pour étudier les propriétés mécaniques et les forces à l'intérieur des cellules vivantes. Alors que les chercheurs développent des approches intelligentes pour atteindre cet objectif, ce sujet à lui seul pourrait être le thème d'un autre symposium passionnant."