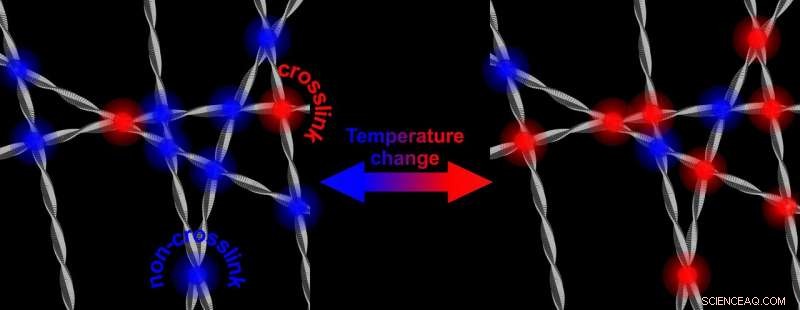
A des températures plus élevées, il y a plus de réticulations rigidifiant le réseau de fibrilles protéiques. L'abaissement de la température a pour résultat un réseau qui est à nouveau moins rigide. Crédit :Université de Twente
Fibrilles de la protéine alpha-synucléine, qui joue un rôle dans la maladie de Parkinson, former un réseau plus rigide et plus solide dans l'eau, lorsque la température augmente. Des chercheurs de l'Université de Twente montrent que cela a à voir avec la partie hydrofuge des fibres venant à la surface et interagissant. Le mécanisme pourrait également jouer un rôle dans l'interaction avec les cellules saines. Des chercheurs de l'Université de Twente publient à ce sujet dans Lettres d'examen physique du 17 mai.
L'alpha-synucléine est abondante dans notre cerveau. On sait qu'il peut se retourner contre nous :dans les maladies neurodégénératives comme Parkinson, la protéine présente un comportement aberrant :après formation de fibrilles, la protéine peut former des plaques. On ne sait toujours pas comment fonctionne ce mécanisme. La recherche maintenant présentée par les scientifiques de l'UT, montre que les propriétés de l'alpha-synucléine sont « ajustables ». dans l'eau, ils formeront un réseau plus rigide et plus solide lorsque la température augmentera. Baisser à nouveau la température, le réseau redevient moins rigide. Bien que tout cela se déroule dans une plage de température qui n'aura jamais lieu dans le cerveau, le mécanisme sous-jacent pourrait donner plus d'informations sur le rôle que jouent les protéines dans l'apparition de la maladie. La rigidité réglable est induite par « l'interaction hydrophobe » :la partie hydrofuge des fibres est l'indice.
La recherche qui est maintenant présentée dans Lettres d'examen physique , montre que le renforcement du réseau est provoqué par une augmentation du nombre de points de contact des fibrilles. Ces points de contact se trouvent tous dans les parties hydrophobes de l'alpha-synucléine. La raison pour laquelle cela est remarquable, est que la partie hydrophobe est normalement « protégée » par les deux autres éléments constitutifs de la protéine :une partie avec une charge électrique et une partie qui est amphiphile (elle aime à la fois l'eau et les lipides). Enlevant ce bouclier et en ouvrant la partie hydrophobe, peut également jouer un rôle dans la maladie :cette partie est capable d'endommager les cellules saines.
Même les mécanismes de défense naturels de l'homme peuvent jouer contre nous, dans ce cas. Des recherches antérieures ont montré que le « nettoyage » des protéines hostiles se fait généralement en « coupant » la partie qui est chargée électriquement, enlevant ainsi le blindage de la partie hydrophobe. Les fibrilles peuvent maintenant trouver des points de contact, former des réseaux et attaquer les membranes cellulaires. De cette façon, la protection naturelle est supprimée.
La recherche aide à comprendre les mécanismes, mais il peut aussi inspirer par ex. nanotechnologues pour créer de nouveaux types de structures artificielles qui peuvent être ajustées. À première vue, la rigidification du réseau est connue à partir des polymères, mais l'interaction hydrophobe est un mécanisme entièrement différent qui pourrait également être utilisé dans des structures artificielles.