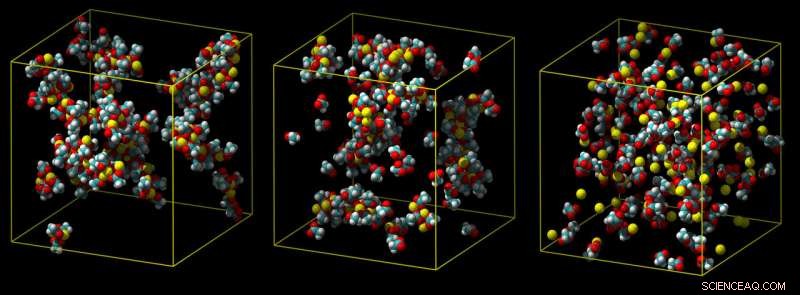
Un modèle standard de calcium surestime la force de liaison du calcium, conduisant à des amas de paires d'ions (à gauche). Un modèle intermédiaire montre moins d'agglutination (milieu), et un modèle d'échelle de charge raffiné prédit correctement une faible association avec les groupes carboxyliques dans l'eau (non illustré) (à droite). Crédit :Philip Mason et Elise Duboue-Dijon
Le calcium est essentiel au bon fonctionnement de notre corps. Les ions calcium permettent aux cellules de communiquer entre elles, permettre aux neurones d'interagir, muscles à contracter, et les cellules musculaires du cœur à se synchroniser et à battre. Pour mieux comprendre ces processus, dans laquelle les ions calcium interagissent avec des molécules biologiques telles que des protéines, les chercheurs utilisent souvent des simulations informatiques. Mais les modèles précis sont difficiles et coûteux en calcul.
"Si vous avez le mauvais modèle de calcium, ça ne fonctionnera tout simplement pas, " a déclaré Pavel Jungwirth de l'Institut de chimie organique et de biochimie de l'Académie tchèque des sciences à Prague. " La plupart des modèles disponibles ne sont pas assez précis pour capturer les caractéristiques importantes de l'ion calcium. "
Dans le numéro de cette semaine de Le Journal de Physique Chimique , cependant, Le groupe de recherche de Jungwirth démontre comment une simple modification d'un modèle informatique conduit à des simulations très précises, qui servent d'outils puissants pour étudier une gamme de processus biologiques. "Je crois que nous avons le meilleur des modèles simples de calcium dans le monde en ce moment, " a déclaré Jungwirth.
Les ions calcium voyagent de cellule en cellule en tant que messagers. Quand ils atteignent une cellule, ils se lient à une molécule, comme une protéine, déclenchant une cascade de réponses chimiques. Mais en raison de l'environnement aqueux de l'ion, simuler exactement comment le calcium se lie est difficile.
L'ion calcium, qui est doublement chargée positivement, interagit fortement avec les oxygènes des molécules d'eau environnantes. Ces oxygènes ont une charge négative partielle (comme dans la molécule d'eau) et l'atome d'oxygène attire plus efficacement les électrons des liaisons. Les forces électrostatiques entre le calcium et l'eau incitent les molécules d'eau à se réorganiser autour de l'ion. L'ion calcium force également les électrons de la molécule d'eau à se déplacer, un phénomène appelé polarisation électronique.
La plupart des simulations intègrent le réarrangement des molécules d'eau. Mais parce que calculer exactement comment les électrons se déplacent nécessite trop de puissance de calcul, ils ne tiennent pas compte de la polarisation électronique. Sans polarisation électronique, Jungwirth a dit, les simulations impliquant le calcium sont inexactes.
Typiquement, les interactions avec les molécules d'eau ont pour effet d'éloigner un ion calcium de la molécule avec laquelle il essaie de se lier, comme dans un bras de fer moléculaire. Si une simulation ne prend pas entièrement en compte ces effets, il surestime la force de liaison du calcium, produire des ions qui ne peuvent pas se délier, ce qui est irréaliste.
Il y a quelques années, cependant, Alexei Stuchebrukhov et Igor Leontyev ont proposé une solution :abaisser la charge électrique des ions dans les simulations. Il s'avère qu'une mise à l'échelle de la charge d'un facteur d'environ 0,75 imite l'effet de la polarisation électronique. Une telle mise à l'échelle simple n'ajoute pas non plus de charge de calcul supplémentaire.
"C'est presque un miracle, " a déclaré Jungwirth. "Nous savons que ce n'est pas une solution parfaite, mais peut-être que cela résout 90 pour cent du problème."
Précédemment, L'équipe de Jungwirth a testé la stratégie en modélisant l'interaction relativement simple entre les ions calcium et chlorure. Pour vérifier si les simulations étaient exactes et si la mise à l'échelle fonctionnait, ils ont fait exploser de vraies solutions de chlorure de calcium avec des neutrons. En mesurant comment ces neutrons se sont dispersés hors du chlorure de calcium aqueux, les chercheurs en ont déduit sa structure et ont comparé les données avec les simulations.
Dans la nouvelle étude, les chercheurs ont testé leur modèle avec des groupes carboxyliques - des groupes moléculaires trouvés dans les protéines, et donc plus pertinent pour la biologie. Après avoir également ajusté la charge du groupe carboxylique, ils ont de nouveau montré que leurs simulations correspondaient très bien aux données d'expériences de diffusion de neutrons.
Parce que les groupes carboxyliques sont simples comparés à, dire, une protéine entière, les chercheurs pourraient également décrire les interactions du calcium à l'aide de calculs de structure électronique précis mais coûteux en calcul. En comparant ces calculs aux simulations, ils ont de nouveau confirmé l'exactitude de leurs modèles.
Ces tests montrent que le nouveau modèle peut simuler les interactions du calcium avec presque toutes les protéines, dit Jungwirth. Les chercheurs ont également développé un modèle analogue qui fonctionne pour les interactions du calcium avec les phospholipides au niveau de la membrane cellulaire. L'étape suivante, il a dit, est de faire de même avec les molécules d'ADN et d'ARN. Et plus loin, les chercheurs prévoient de développer un modèle similaire pour le magnésium, un autre ion de signalisation important avec ses propres défis uniques.