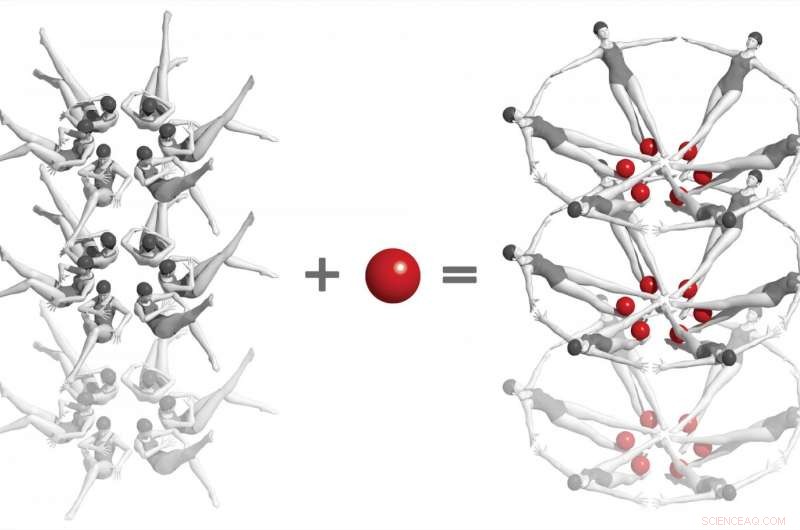
Dans une expérience historique au Laboratoire national des accélérateurs du SLAC, les scientifiques ont utilisé un laser à rayons X pour capturer les premiers instantanés d'une interaction chimique entre deux biomolécules en temps réel et à un niveau atomique. Il s'agit de « riboswitchs » issus d'ARN bactérien – représentés ici comme des nageurs synchronisés – et d'une petite molécule appelée adénine (boules rouges). Quand les deux interagissent, les riboswitchs prennent une forme radicalement différente, et cela change à son tour la forme des cristaux dans lesquels ils sont incrustés. Des études comme celles-ci, ce qui ne peut être fait qu'avec des lasers à rayons X à électrons libres, ouvrir la voie à la compréhension du fonctionnement de l'ARN et d'autres biomolécules complexes, et finalement au développement de traitements contre la maladie. Crédit :Joseph Meyer/Frederick Laboratoire national de recherche sur le cancer
Les scientifiques ont utilisé le puissant laser à rayons X du laboratoire national de l'accélérateur SLAC du ministère de l'Énergie pour réaliser les premiers instantanés d'une interaction chimique entre deux biomolécules - l'une qui actionne un « commutateur » d'ARN qui régule la production de protéines, la bête de somme des molécules de la vie.
Les résultats, publié aujourd'hui dans La nature , montrer le potentiel révolutionnaire des lasers à rayons X à électrons libres, ou XFEL, pour étudier l'ARN, qui guide la fabrication des protéines dans la cellule, sert de matériel génétique primaire dans les rétrovirus tels que le VIH et joue également un rôle dans la plupart des formes de cancer.
Et parce que ce type particulier de commutateur d'ARN, connu sous le nom de riboswitch, ne se trouve que dans les bactéries, une compréhension plus approfondie de sa fonction peut offrir un moyen de désactiver la production de protéines et de tuer les germes nocifs sans provoquer d'effets secondaires chez les humains qu'ils infectent.
"Des expériences précédentes au laser à rayons X du SLAC ont étudié des réactions biologiques comme la photosynthèse qui sont déclenchées par la lumière. Mais c'est la première à en observer une qui est déclenchée par l'interaction chimique de deux biomolécules en temps réel et à l'échelle atomique, " a déclaré Yun-Xing Wang, un biologiste structural au Centre de recherche sur le cancer de l'Institut national du cancer qui a dirigé l'équipe de recherche internationale.
« Cela démontre vraiment la capacité unique des lasers à électrons libres à rayons X qu'aucune technologie actuelle, ou toute autre technologie à l'horizon, peut faire. C'est comme si vous aviez un appareil photo avec une vitesse d'obturation très rapide, afin que vous puissiez saisir chaque mouvement des biomolécules en action."
Les expériences ont été réalisées à la source de lumière cohérente Linac (LCLS) du SLAC, une installation utilisateur du DOE Office of Science. Ils sont les premiers à démontrer comment les XFEL peuvent prendre des instantanés et potentiellement réaliser des films d'ARN et d'autres biomolécules lorsqu'ils interagissent chimiquement - offrant un aperçu du fonctionnement fondamental de la cellule qui ne peut être obtenu autrement.
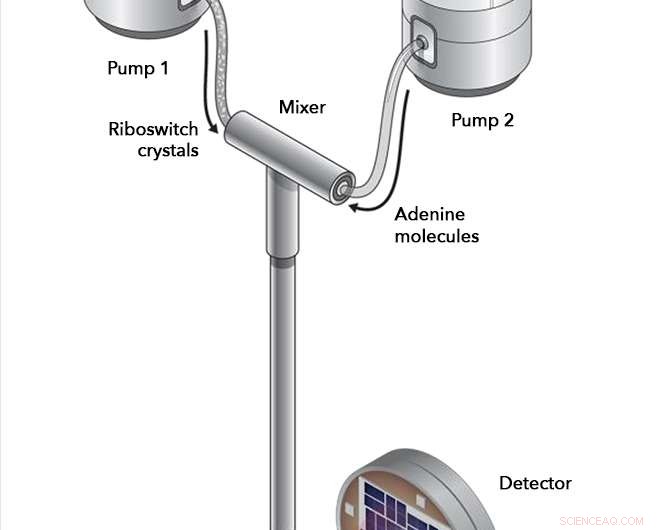
Dans des expériences à la source de lumière cohérente Linac du SLAC, des cristaux de riboswitch et des molécules d'adénine ont été pompés dans une chambre de mélange, où ils ont été autorisés à interagir pendant des intervalles soigneusement chronométrés avant d'être injectés dans le trajet du faisceau laser à rayons X. Les rayons X ont rebondi sur les molécules du riboswitch et dans un détecteur, l'enregistrement de tout changement dans la structure du riboswitch qui a eu lieu. Crédit :Joseph Meyer/Institut national du cancer
Voir l'ARN changer de forme
L'ARN est un élément clé du matériel génétique de toutes les cellules vivantes. Il existe plusieurs types qui agissent ensemble pour guider la production de protéines par les ribosomes de la cellule, selon des plans codés dans l'ADN.
Mais l'ADN et l'ARN contiennent également de vastes régions qui ne codent pour aucune protéine - la soi-disant "matière noire" génétique. Les scientifiques ont pensé pendant de nombreuses années que ces régions ne faisaient rien. Maintenant, ils savent qu'ils jouent un rôle important pour déterminer où et quand les gènes s'allument et s'éteignent et affinent autrement leur fonction. La grande majorité des cancers sont dus à des mutations dans ces régions non codantes, Wang a dit, comprendre le fonctionnement de ces régions est donc important pour la recherche sur le cancer ainsi que pour la biologie fondamentale.
Cependant, il est difficile de déterminer ce que font les régions non codantes de l'ARN. Les molécules d'ARN sont bancales et flexibles, il est donc difficile de les incorporer dans les gros cristaux généralement nécessaires pour étudier leur structure atomique au niveau des sources lumineuses à rayons X.
LCLS supprime cette barrière en permettant aux scientifiques d'obtenir des informations structurelles de beaucoup plus petits, cristaux nanométriques, qui sont beaucoup plus faciles à faire. Ses puissantes impulsions laser à rayons X, un milliard de fois plus lumineux que tout ce qui était disponible auparavant, sont si courts qu'ils collectent les données de chaque cristal en quelques millionièmes de milliardième de seconde, avant que les dommages causés par les rayons X ne s'installent.
L'équipe de Wang a étudié un riboswitch de Vibrio vulnificus, une bactérie apparentée à celle qui cause le choléra. Le riboswitch se trouve dans un long brin d'ARN messager (ARNm), qui copie les instructions de l'ADN pour fabriquer une protéine afin qu'elles puissent être lues et exécutées par le ribosome. L'interrupteur agit comme un thermostat qui régule la production de protéines.