Dans le modèle planétaire de la structure atomique, un atome est constitué d'un noyau lourd, chargé positivement, entouré d'un nuage d'électrons beaucoup plus légers et chargés négativement. Les protons fournissent la charge positive, et chaque élément en a un nombre différent. Le nombre de protons dans le noyau détermine le numéro atomique d'un élément. C'est différent de la masse atomique ou du poids atomique, qui tiennent compte de la présence de neutrons. Chaque atome d'un élément donné a toujours le même numéro atomique, mais la masse atomique peut varier en fonction du nombre de neutrons dans le noyau.
TL; DR (trop long; n'a pas lu)
Le numéro atomique est le nombre de protons dans le noyau d'un élément. Il définit la position de l'élément dans le tableau périodique. La masse atomique, qui est un autre nombre qui apparaît à côté du symbole de l'élément, est une moyenne des masses atomiques de tous les isotopes de cet élément.
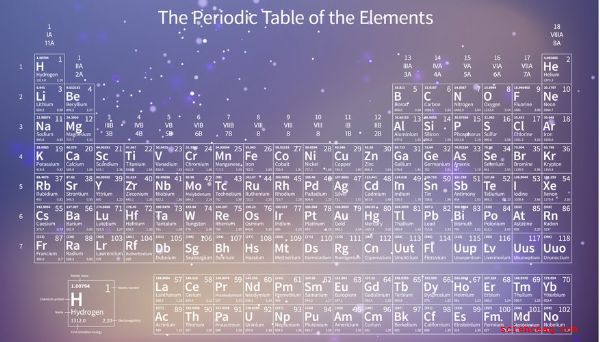
Le tableau périodique
Le tableau périodique est un graphique qui répertorie tous les éléments dans l'ordre en fonction du nombre atomique croissant. Les scientifiques connaissent 118 éléments. Le numéro 118, oganesson (Og), qui est un élément radioactif produit artificiellement, a été ajouté en 2015. Oganesson a le numéro atomique le plus élevé parce qu'il a le plus grand nombre de protons dans son noyau. L'hydrogène (H), d'autre part, n'a qu'un seul proton dans son noyau, donc son numéro atomique est 1, et il apparaît au début du tableau périodique. Le numéro atomique de chaque élément, qui est le nombre de protons dans son noyau, apparaît à côté de son symbole dans le tableau. Si le numéro atomique n'était pas là, vous pourriez toujours dire combien de protons étaient dans le noyau d'un élément donné en comptant le nombre de places entre cet élément et l'hydrogène.
Le numéro atomique n'est pas une masse atomique ou un poids atomique
Si vous recherchez un élément dans le tableau périodique, vous verrez un autre numéro à côté de son numéro atomique. Il s'agit du poids atomique de l'élément, et c'est généralement le double du nombre atomique ou plus. Le poids atomique n'est pas la même chose que la masse atomique.
La masse atomique d'un atome est la masse de tous les protons et neutrons du noyau. Les électrons ont de si petites masses par rapport aux nucléons qu'ils sont considérés comme négligeables. La masse atomique est exprimée en unités de masse atomique (amu) pour un seul atome et en grammes par mole pour les quantités macroscopiques. Une taupe est quantifiée comme le nombre d'Avogadro (6,02 × 10 23) d'atomes. Un atome d'un élément donné a toujours le même nombre de protons. S'il avait un numéro différent, ce serait un élément différent. Cependant, les atomes d'un même élément peuvent avoir différents nombres de neutrons. Chaque version est appelée isotope de cet élément, et chaque isotope a une masse atomique différente. La masse atomique indiquée dans le tableau périodique est une moyenne des masses atomiques de tous les isotopes naturels de cet élément. Cette moyenne est le poids atomique de cet élément.