Les chercheurs du Boston College ont utilisé une légère charge d'électricité pour modifier avec précision les protéines, un nouvel outil qui peut être utilisé pour développer de nouveaux outils de recherche biothérapeutiques et basés sur les protéines, a récemment rapporté l'équipe dans la revue Nature Chemistry. .
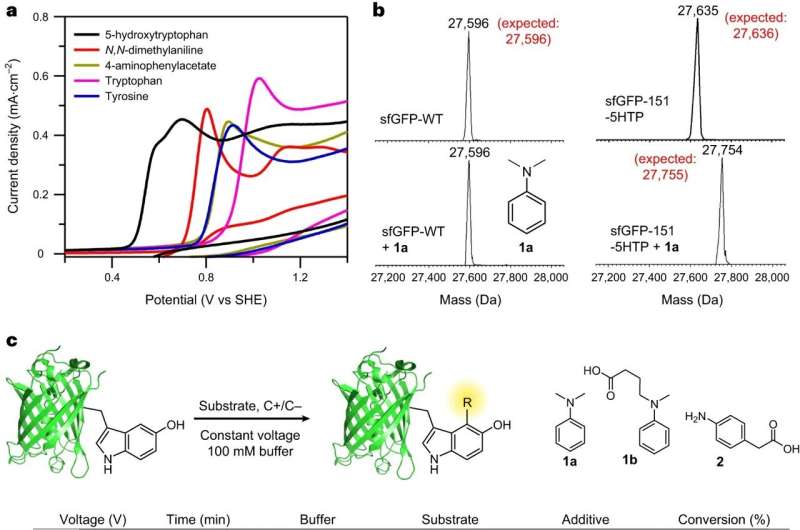
L'équipe, dirigée par les professeurs de chimie Abhishek Chatterjee et Eranthie Weerapana de Colombie-Britannique, a développé et optimisé une nouvelle réaction de marquage électrochimique des protéines appelée « eCLIC » qui permet une modification précise des résidus de 5-hydroxytryptophane (5HTP) incorporés de manière spécifique sur de nombreuses protéines différentes, y compris les Anticorps thérapeutiques de longueur.
"Nous avons utilisé cette stratégie pour générer de nombreux conjugués protéiques spécifiques à un site, y compris un conjugué anticorps-médicament cytotoxique qui pénètre et tue sélectivement les cellules cancéreuses, mais pas les cellules non cancéreuses", a déclaré Chatterjee. "L'un des principaux avantages d'eCLIC est que les réactifs nécessaires à cette méthode sont vraiment peu coûteux, coûtant moins de 10 $ le gramme."
Le succès de l'équipe a marqué la première fois que l'électrocatalyse a été utilisée pour réaliser une modification des protéines d'une manière spécifique à un site, ont-ils rapporté dans leur article "Marquage électrochimique des hydroxyindoles avec chimiosélectivité pour la bioconjugaison de protéines spécifiques à un site".
Les protéines sont de grosses molécules, généralement composées de centaines de monomères d’acides aminés, a noté Chatterjee. La capacité de modifier sélectivement les protéines sur des sites prédéfinis est importante pour de nombreuses applications. Par exemple, en liant de manière covalente des médicaments toxiques à des anticorps, il a été possible de les délivrer sélectivement aux cellules cancéreuses, ce qui a entraîné à la fois une efficacité thérapeutique améliorée et une toxicité hors cible réduite.
De nombreuses applications de recherche nécessitent également la fixation de sondes biophysiques sur diverses protéines. La capacité de définir le site de modification sur les protéines est essentielle pour garantir que les fonctions importantes des protéines ne soient pas altérées, a déclaré Chatterjee.
"Le défi vient du fait que toutes les protéines sont constituées de 20 acides aminés dans diverses combinaisons", a-t-il déclaré. "L'identification d'une fonctionnalité modifiable sur le site souhaité, non répétée ailleurs, est généralement un défi, ce qui rend difficile l'obtention d'une spécificité de site dans la modification des protéines."
Pour surmonter ces défis, l'équipe a cherché à développer une méthode permettant d'incorporer un acide aminé non naturel à n'importe quel(s) site(s) choisi(s) d'une protéine. L'équipe y est parvenue en réorganisant le système de traduction des cellules pour s'adapter au nouvel acide aminé 5HTP.
De plus, les chercheurs voulaient concevoir des réactions chimiques qui pourraient être utilisées pour modifier sélectivement cet acide aminé non naturel en présence de tous les acides aminés naturels, a expliqué Chatterjee.
"Si nous pouvions faire cela, nous pourrions fournir une méthode générale pour générer des protéines avec une "poignée de fixation" intégrée sur un site prédéfini. En particulier, nous étions intéressés par le développement d'une réaction qui utiliserait l'électricité pour catalyser la modification des protéines. réaction au lieu d'une catalyse chimique puisque la première est peu coûteuse, respectueuse de l'environnement et douce pour les protéines délicates. "
Chatterjee a déclaré que l'équipe était capable de surmonter un défi inhabituel lorsqu'elle a essayé pour la première fois de modéliser la réaction. Généralement, les chercheurs commencent par de petites molécules, dans ce cas, le 5HTP et l'aniline, puis passent aux grosses protéines.
Mais les premières tentatives de réaction entre le 5HTP et les anilines au niveau des petites molécules ont été compliquées, car les molécules de 5HTP réagissaient préférentiellement les unes avec les autres. Mais lorsque le 5HTP était incorporé dans une grosse protéine, il n'était plus capable de réagir avec un autre 5HTP lié à une protéine et réagissait proprement avec une aniline, a rapporté l'équipe.
"Si nous nous en étions tenus à la progression traditionnelle - de petit à grand - nous n'aurions jamais poursuivi eCLIC, pensant que c'était trop compliqué", a déclaré Chatterjee. "Au lieu de cela, nous avons développé notre réaction de manière non traditionnelle, directement sur une protéine, ce qui nous a aidé à réaliser à quel point elle était propre et sélective dans ce contexte."
Pour faire progresser davantage la stratégie eCLIC de modification à grande échelle de cibles protéiques importantes, cette technologie a été concédée sous licence à BrickBio, Inc., cofondée par Chatterjee. Les recherches futures se concentreront sur le développement de réactifs biothérapeutiques et de recherche à base de protéines modifiées spécifiquement sur un site de nouvelle génération.
Plus d'informations : Conor Loynd et al, Marquage électrochimique des hydroxyindoles avec chimiosélectivité pour la bioconjugaison de protéines spécifiques à un site, Nature Chemistry (2023). DOI :10.1038/s41557-023-01375-y
Fourni par Boston College