Comprendre le comportement de la matière est crucial pour faire progresser des domaines scientifiques comme la biologie, la chimie et la science des matériaux. La cristallographie aux rayons X a joué un rôle déterminant dans cette quête, permettant aux scientifiques de déterminer les structures moléculaires avec précision.
Dans les expériences traditionnelles de cristallographie aux rayons X, un monocristal est exposé plusieurs fois aux rayons X pour obtenir des signaux de diffraction. Cela pose un problème lorsque la structure de l'échantillon est altérée ou endommagée par l'exposition aux rayons X.
Ces dernières années, les progrès technologiques ont permis le développement de la « cristallographie femtoseconde série résolue en temps » (TR-SFX). En cristallographie en série, un cristal n'est exposé aux rayons X qu'une seule fois, ce qui permet de mesurer l'échantillon dans le meilleur état possible, où le cristal n'est pas endommagé par les rayons X. Ceci est ensuite combiné avec la technique populaire de résolution temporelle, qui permet de suivre les changements structurels des molécules dans les cristaux en temps réel au cours d'une réaction.
Cependant, jusqu’à présent, TR-SFX s’est limité à l’étude d’échantillons de protéines. Si l'utilisation du TR-SFX peut être étendue à des échantillons non protéiques, cela ouvrira la voie à des opportunités d'étudier le mouvement en temps réel sur une plus large gamme de matériaux, y compris ceux cruciaux pour les semi-conducteurs et les batteries.
Pour la première fois, des chercheurs dirigés par le directeur de l'IHEE Hyotcherl du Center for Advanced Reaction Dynamics de l'Institut des sciences fondamentales (IBS) ont appliqué le TR-SFX à un système autre que les protéines. Le travail a été publié dans Nature Chemistry .
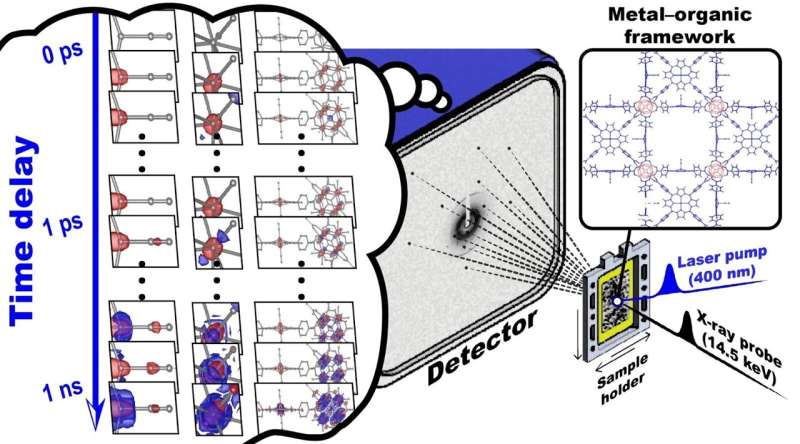
Le matériau qu'ils ont choisi était un échantillon appelé réseau de coordination poreux – 224 (Fe), PCN – 224 (Fe), pour démontrer la faisabilité de la cristallographie en série au niveau moléculaire, leur permettant d'observer le mouvement moléculaire en temps réel avec une résolution atomique. /P>
L'échantillon est constitué de monoxyde de carbone (CO) adsorbé sur des dérivés de porphyrine de fer (Fe porphyrine) et des amas de zirconium (Zr) répétés dans une structure métallo-organique.
La raison pour laquelle TR-SFX était auparavant limité à l’étude d’échantillons protéiques était que des normes beaucoup plus élevées sont requises pour évaluer les structures d’échantillons non protéiques. L'équipe IBS a donc dû améliorer considérablement les spécifications de la cristallographie afin de répondre à ces critères élevés.
La configuration de l'équipe a révélé la structure cristalline à un total de 33 instants allant de 100 femtosecondes à 3 nanosecondes (10 -9 secondes). Il s’agit d’une avancée par rapport aux précédentes études TR-SFX sur les protéines, qui rapportent généralement des structures cristallines à seulement 10 points dans le temps environ. Cette augmentation substantielle de la résolution temporelle, près de trois fois supérieure aux études précédentes sur les protéines, a permis une représentation plus précise des changements structurels sur une longue période de temps.
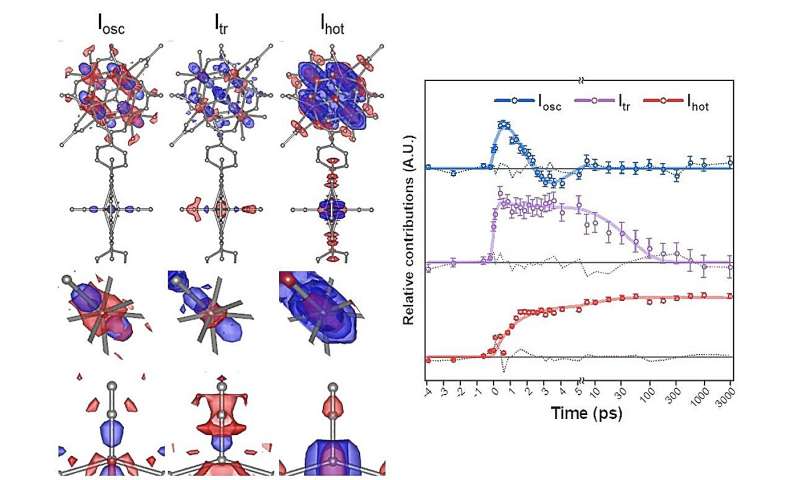
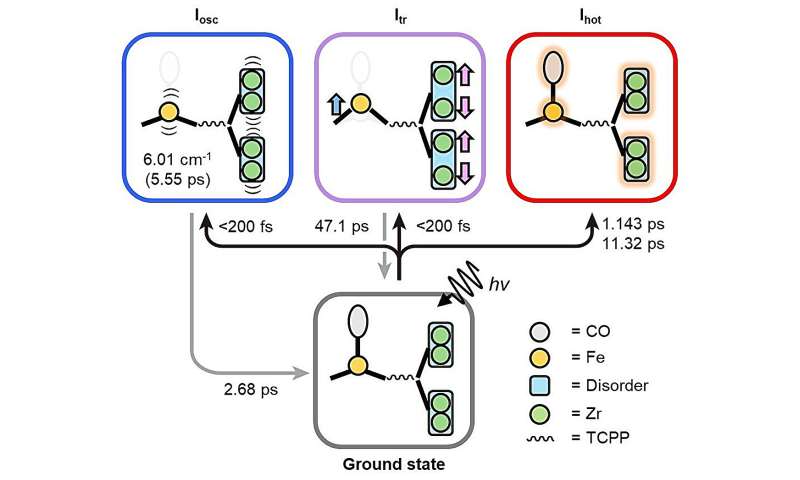
Lorsque le PCN-224 (Fe) est irradié par la lumière, le CO adsorbé sur la porphyrine Fe est dissocié, déclenchant une cascade de changements structurels. Grâce au TR-SFX amélioré, les chercheurs ont pu observer ces changements structurels avec des détails sans précédent, avec une résolution temporelle femtoseconde de 10 -15 . secondes et une résolution atomique de 10 -10 mètres (ou angströms).
Ils ont pu identifier trois voies différentes de changement structurel :le bombage, le mouvement des atomes de fer dans les porphyrines de fer hors du plan des porphyrines ; mode phonon des atomes de zirconium et de fer ; et un mouvement vibratoire aléatoire avec l'augmentation de la température.
Avec cette étude, les chercheurs ont montré qu'il est possible d'appliquer les mesures TR-SFX aux systèmes chimiques, une avancée importante dans la démonstration du caractère pratique de la technique.
L’étude marque une étape majeure pour la communauté scientifique car c’est la première fois que le comportement moléculaire est observé en temps réel à l’aide de la cristallographie en série. En utilisant TR-SFX, une technique qui offre une résolution spatio-temporelle élevée, l'équipe a pu capturer en temps réel d'infimes changements structurels dans les molécules à l'état solide.
Le directeur Ihee du Center for Advanced Molecular Reaction Dynamics a déclaré :« Étant donné que les avancées techniques et les méthodes analytiques proposées dans cette étude peuvent être largement utilisées pour observer de nombreuses autres réactions en phase cristalline de divers systèmes moléculaires, cette recherche ouvre non seulement de nouveaux horizons dans le domaine. de la recherche sur la structure moléculaire, mais a également des applications infinies dans les futures découvertes scientifiques. "
Plus d'informations : Structures 3D dynamiques d'une structure métallo-organique capturées par cristallographie en série femtoseconde, Nature Chemistry (2024). DOI :10.1038/s41557-024-01460-w
Informations sur le journal : Chimie naturelle
Fourni par l'Institut des sciences fondamentales