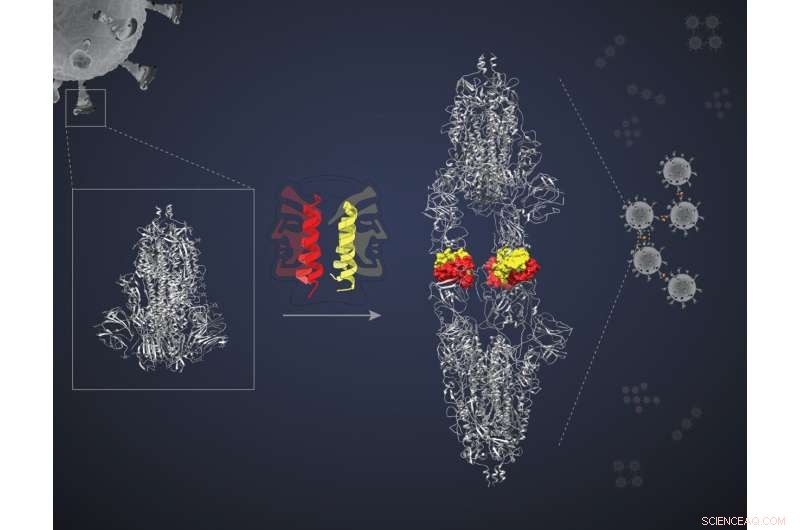
Dimérisation de la protéine de pointe par un «peptide à deux faces». Crédit :Bhavesh Khatri
L'émergence rapide de nouvelles souches du virus SARS-CoV-2 a diminué la protection offerte par les vaccins COVID-19. Une nouvelle approche développée par des chercheurs de l'Indian Institute of Science (IISc) fournit désormais un mécanisme alternatif pour rendre inactifs des virus comme le SARS-CoV-2.
Dans une étude publiée dans Nature Chemical Biology , les chercheurs rapportent la conception d'une nouvelle classe de peptides artificiels ou de miniprotéines qui peuvent non seulement bloquer l'entrée du virus dans nos cellules, mais aussi agglutiner les virions (particules virales), réduisant ainsi leur capacité à infecter.
Une interaction protéine-protéine ressemble souvent à celle d'une serrure et d'une clé. Cette interaction peut être entravée par une miniprotéine fabriquée en laboratoire qui imite, rivalise avec et empêche la "clé" de se lier à la "serrure", ou vice versa.
Dans la nouvelle étude, l'équipe a exploité cette approche pour concevoir des miniprotéines qui peuvent se lier et bloquer la protéine de pointe à la surface du virus SARS-CoV-2. Cette liaison a ensuite été largement caractérisée par cryo-microscopie électronique (cryo-EM) et d'autres méthodes biophysiques.
Ces miniprotéines sont des peptides hélicoïdaux en forme d'épingle à cheveux, chacune capable de s'apparier avec une autre de son espèce, formant ce qu'on appelle un dimère. Chaque "paquet" dimérique présente deux "faces" pour interagir avec deux molécules cibles. Les chercheurs ont émis l'hypothèse que les deux faces se lieraient à deux protéines cibles distinctes enfermant les quatre dans un complexe et bloquant l'action des cibles. "Mais nous avions besoin d'une preuve de principe", explique Jayanta Chatterjee, professeur agrégé à l'unité de biophysique moléculaire (MBU), IISc, et auteur principal de l'étude. L'équipe a décidé de tester leur hypothèse en utilisant l'une des miniprotéines appelée SIH-5 pour cibler l'interaction entre la protéine Spike (S) du SRAS-CoV-2 et la protéine ACE2 dans les cellules humaines.
La protéine S est un trimère, un complexe de trois polypeptides identiques. Chaque polypeptide contient un domaine de liaison au récepteur (RBD) qui se lie au récepteur ACE2 à la surface de la cellule hôte. Cette interaction facilite l'entrée virale dans la cellule.
La miniprotéine SIH-5 a été conçue pour bloquer la liaison du RBD à l'ACE2 humain. Lorsqu'un dimère SIH-5 a rencontré une protéine S, l'une de ses faces s'est étroitement liée à l'un des trois RBD sur le trimère de la protéine S, et l'autre face s'est liée à un RBD d'une protéine S différente. Cette "réticulation" a permis à la miniprotéine de bloquer les deux protéines S en même temps. "Plusieurs monomères peuvent bloquer leurs cibles", explique Chatterjee. "[Mais] la réticulation des protéines S bloque leur action beaucoup plus efficacement. C'est ce qu'on appelle l'effet d'avidité."
Sous cryo-EM, les protéines S ciblées par SIH-5 semblaient être attachées tête à tête. "Nous nous attendions à voir un complexe d'un trimère de pointe avec des peptides SIH-5. Mais j'ai vu une structure beaucoup plus allongée", explique Somnath Dutta, professeur adjoint à la MBU et l'un des auteurs correspondants. Dutta et les autres ont réalisé que les protéines de pointe étaient forcées de former des dimères et de s'agglutiner en complexes avec la miniprotéine. Ce type d'agglutination peut inactiver simultanément plusieurs protéines de pointe du même virus et même plusieurs particules virales. "J'ai déjà travaillé avec des anticorps dirigés contre la protéine de pointe et je les ai observés sous un cryo-EM. Mais ils n'ont jamais créé de dimères de pointes", explique Dutta.
La miniprotéine s'est également avérée thermostable - elle peut être conservée pendant des mois à température ambiante sans se détériorer.
L'étape suivante consistait à demander si le SIH-5 serait utile pour prévenir l'infection au COVID-19.
Pour répondre à cette question, l'équipe a d'abord testé la toxicité de la miniprotéine dans des cellules de mammifères en laboratoire et l'a trouvée sans danger. Ensuite, dans des expériences menées dans le laboratoire de Raghavan Varadarajan, professeur au MBU, des hamsters ont été dosés avec la miniprotéine, suivis d'une exposition au SRAS-CoV-2. Ces animaux n'ont montré aucune perte de poids et avaient une charge virale considérablement réduite ainsi que beaucoup moins de dommages cellulaires dans les poumons, par rapport aux hamsters exposés uniquement au virus.
Les chercheurs pensent qu'avec des modifications mineures et une ingénierie peptidique, cette miniprotéine fabriquée en laboratoire pourrait également inhiber d'autres interactions protéine-protéine. Concevoir des inhibiteurs peptidiques pour d'éventuels traitements COVID-19