Crédit :domaine public CC0
Un nouveau peptide développé aux universités de Bayreuth et de Bristol est particulièrement adapté au transport ciblé de molécules—par exemple, de substances actives et de colorants—dans les cellules des mammifères. Le peptide est caractérisé par une double fonction :il peut pénétrer dans la cellule par l'extérieur et y interagir avec un peptide partenaire. Le peptide partenaire doit avoir été préalablement placé à l'intérieur de la cellule exactement là où les molécules transportées doivent agir. Le système de transport présenté dans la revue Nature Chemical Biology illustre le potentiel prometteur d'une conception de novo de peptides et de protéines.
Ces dernières années, la biomédecine et la pharmacologie ont développé un grand nombre de substances actives capables de déclencher, d'améliorer ou d'inhiber des processus dans les cellules de mammifères. Cependant, le transport de ces substances exactement là où elles sont nécessaires reste un défi dans de nombreux cas. La situation est similaire lorsqu'il s'agit de marquer en couleur certaines structures à l'intérieur des cellules à des fins de recherche ou de diagnostic. Il est vrai que les cellules de mammifères ont la capacité d'incorporer des substances étrangères par endocytose. Mais cela ne garantit en aucun cas le transport vers le site d'action souhaité. Une nouvelle approche de recherche que la biochimiste de Bayreuth, Prof. Dr. Birte Höcker, poursuit avec son groupe de recherche est la conception rationnelle de peptides. Ceux-ci doivent pouvoir pénétrer à l'intérieur de la cellule depuis l'extérieur et emporter avec eux des substances actives ou des molécules de colorant fixées. Les peptides adaptés à cette fin sont plutôt petits car ils se composent généralement de moins de 30 acides aminés.
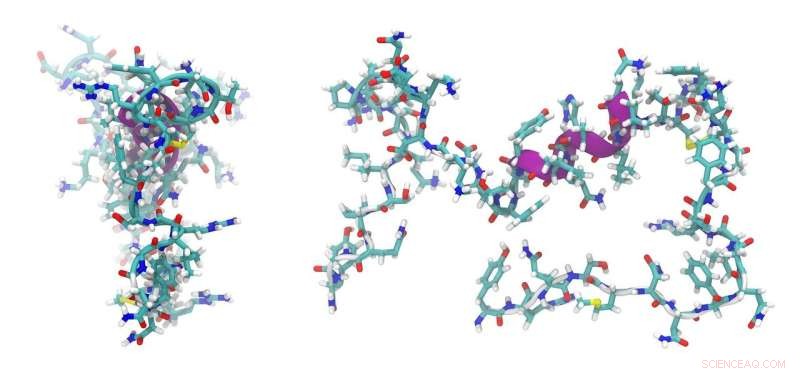
Jusqu'à présent, cependant, le problème était que ces peptides - précisément en raison de leur simplicité et de leur petite taille - n'offraient pas beaucoup d'applications possibles. En effet, il n'y a que quelques zones dans les diverses structures de l'intérieur de la cellule où elles peuvent s'ancrer et délivrer les molécules qu'elles transportent. Cet inconvénient a été surmonté par le peptide développé à Bayreuth et Bristol. C'est un peptide basique à haute teneur en acides aminés arginine, et il a deux composants essentiels pour sa fonctionnalité. L'un permet au peptide de pénétrer à l'intérieur de la cellule et l'autre est capable d'interagir avec un peptide partenaire acide. Ce peptide partenaire est tel qu'il peut être placé à des endroits très différents à l'intérieur de la cellule en utilisant des méthodes biochimiques établies. Une fois que les protéines, les complexes moléculaires plus grands ou les organites ont été marqués avec le peptide partenaire, ils peuvent être ciblés par le peptide de base qui est entré dans la cellule. Comme une clé dans une serrure, le peptide basique se verrouille sur le peptide acide. Le placement ciblé du peptide partenaire acide est obtenu en le couplant avec des molécules qui sont à leur tour introduites dans l'ADN de la cellule par transfection.
L'équipe de recherche anglo-allemande a conçu les deux peptides de novo jusqu'alors inconnus en utilisant des méthodes de conception de protéines assistée par ordinateur. La base de ce travail était des peptides avec une structure enroulée, qui ont été décrits dans une base de données de structure. Les peptides conçus sur ordinateur ont ensuite été synthétisés en laboratoire. Ici, des méthodes biophysiques et une cristallographie aux rayons X ont été utilisées pour identifier les propriétés et le comportement réels des peptides. Des expériences avec des bactéries E. coli et des cellules eucaryotes ont révélé que le nouveau système peptidique est même adapté au transport d'autres peptides et protéines.
"Our investigations exemplify how the computational design of peptides and proteins, their subsequent synthesis and characterization in the laboratory, as well as testing in living cells can intertwine when innovative solutions for biochemical or biomedical questions are being sought," says Prof. Dr. Birte Höcker, head of the Protein Design Group at the University of Bayreuth and corresponding author of the new study.
"The new peptide system makes it clear that de novo design is a promising research approach in the search for methods that enable drug or dye molecules to be introduced into mammalian cells in a targeted and gentle manner," adds Dr. Guto Rhys, postdoc at the Protein Design research group and one of the three first authors. Fluorescent peptide nanoparticles, in every color of the rainbow