Une illustration montrant le point chaud contrôlé par des pincettes optiques pour la caractérisation structurelle des protéines par spectroscopie Raman à surface améliorée. Crédit :Vince St. Dollente Mesias, Jinqing Huang / Université des sciences et technologies de Hong Kong
Il est difficile d'analyser les protéines à de faibles concentrations, en particulier pour ceux dans un mélange de diverses conformations telles que les protéines intrinsèquement désordonnées (IDP). Une équipe de recherche dirigée par le professeur Huang Jinqing, Professeur assistant du département de chimie à l'Université des sciences et technologies de Hong Kong (HKUST), a développé une spectroscopie Raman couplée à des pincettes optiques qui peut directement sonder les caractéristiques structurelles de l'alpha-synucléine, un IDP étroitement lié à la maladie de Parkinson, à la concentration physiologique en se concentrant sur des molécules de protéines individuelles.
Les PDI jouent un rôle important dans les processus biologiques et nombre d'entre elles sont associées à des maladies neurodégénératives incurables. En tant que PDI type, L'alpha-synucléine n'a pas d'architecture 3-D stable connue sous le nom de structures secondaires. Il subit spontanément des conversions d'une structure secondaire à une autre, ce qui pourrait éventuellement entraîner l'accumulation d'agrégats de protéines impliqués dans la pathologie de la maladie de Parkinson. Cependant, les espèces transitoires lors de la conversion possèdent diverses structures et existent en faible population parmi un mélange d'équilibre dynamique. Par conséquent, leurs caractéristiques structurelles sont généralement enfouies sous les résultats de détection des techniques de mesure traditionnelles, qui font la moyenne des signaux détectés à partir de grandes quantités d'échantillons et d'un long temps de détection.
Dans l'étude, Le professeur Huang et ses collaborateurs intègrent des pincettes optiques et la spectroscopie Raman à surface améliorée (SERS) dans une nouvelle plate-forme pour générer des améliorations SERS réglables et reproductibles avec une sensibilité au niveau d'une molécule unique dans des environnements aqueux, afin de caractériser ces PDI tout en maintenant leur hétérogénéité intrinsèque à grande signification biologique. Spécifiquement, un hotspot peut être visualisé et contrôlé par des pincettes optiques pour laisser passer les protéines dans une chambre à flux microfluidique, ce qui permet d'ajuster les paramètres de mesure en temps réel pour les caractérisations spectroscopiques in situ. Il identifie directement les caractéristiques structurales de l'espèce transitoire de l'alpha-synucléine parmi ses monomères prédominants à concentration physiologique de 1 M en réduisant l'ensemble en faisant la moyenne en quantité et en temps, fournissant un aperçu approfondi pour comprendre l'initiation de l'agrégation des protéines amyloïdes. D'où, cette plateforme SERS a un grand potentiel pour révéler les informations structurelles des personnes déplacées dans la dynamique, hétérogène, et des systèmes biologiques complexes.
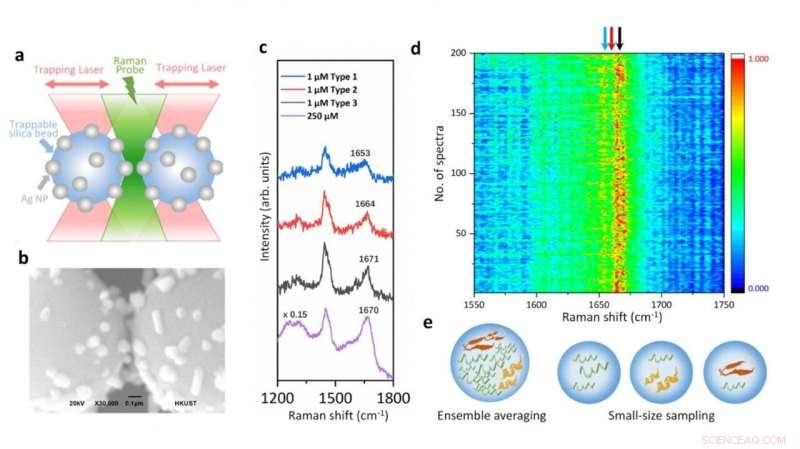
Illustration de la plate-forme de spectroscopie Raman couplée à des pincettes optiques et des spectres SERS de l'alpha-synucléine à concentration physiologique montrant les variations structurelles dues à ses espèces transitoires. Crédit :Vince St. Dollente Mesias, Jinqing Huang/Université des sciences et technologies de Hong Kong
"Notre stratégie permet le contrôle précis du point chaud entre deux billes de silice recouvertes de nanoparticules d'argent piégées de taille micrométrique pour améliorer l'efficacité et la reproductibilité du SERS dans les détections aqueuses. À l'exception de l'amélioration SERS réglable, les pincettes optiques intégrées offrent également une résolution spatiale sub-nanométrique et une sensibilité à la force sub-piconewton pour surveiller les interactions lumière-matière dans le point chaud plasmonique pour un aperçu physique supplémentaire. Plus important, notre méthode ouvre une nouvelle porte pour caractériser les espèces transitoires de PDI dans des solutions diluées, qui reste un défi important dans la communauté biophysique. Finalement, il sera passionnant d'exploiter pleinement la manipulation précise de la force de la pince à épiler optique intégrée pour déployer une seule protéine à l'intérieur du point chaud contrôlable et résoudre sa dynamique structurelle à partir des vibrations moléculaires endogènes par la spectroscopie Raman intégrée, " a déclaré le professeur Huang.
L'étude a récemment été publiée dans la revue scientifique Communication Nature .