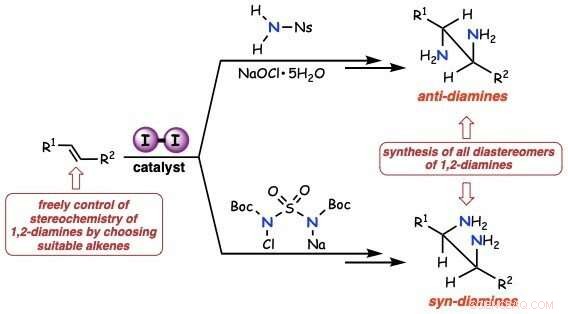
Figure 1. Diagramme schématique des anti- et syn-diaminations d'alcènes utilisant un catalyseur à l'iode. Crédit :Université d'Osaka
Synthétiser des produits pharmaceutiques pour le cancer, maladies virales, et d'autres conditions médicales est un travail lent. Une transformation chimique particulièrement difficile consiste à commencer par ce que l'on appelle un alcène non activé, un élément de construction moléculaire commun, et à aboutir à une diamine vicinale; c'est à dire., installation de deux unités d'azote dans des doubles liaisons carbone-carbone. Le résultat est une unité chimique présente dans les médicaments contre la grippe et le cancer colorectal.
Communément, les chercheurs doivent utiliser rare, métaux toxiques et des conditions de réaction difficiles pour achever cette transformation. L'utilisation d'un catalyseur plus durable pour la réaction pourrait résoudre de tels problèmes. Des recherches antérieures ont tenté de le faire, mais avec un succès limité.
Dans une étude publiée récemment dans le Journal de l'American Chemical Society , des chercheurs de l'université d'Osaka ont synthétisé des diamines vicinales à partir d'alcènes non activés, en utilisant l'iode comme catalyseur. Le protocole synthétique, approprié à la fois pour l'anti-addition et la syn-addition, est réaliste, utile, et respectueux de l'environnement.
"Nous avons synthétisé tous les diastéréomères des diamines vicinales par anti-addition - en ajoutant deux substituants aux côtés opposés de la double liaison, " dit Satoshi Minakata, auteur principal et principal. "En présence d'un catalyseur d'iode moléculaire, alcènes non activés ayant réagi avec du nosylamide et de l'hypochlorite de sodium disponibles dans le commerce, pour produire les produits visés d'une manière stéréospécifique. »
Les réactions étaient terminées en 12 heures à seulement 40 °C pour de nombreux types d'alcènes cycliques et terminaux, tels que les dérivés du styrène. La diamination d'un alcène interne avec un contrôle précis de la forme tridimensionnelle des produits de réaction finaux - important dans de nombreuses molécules médicamenteuses - n'a nécessité que des ajustements mineurs de la température de réaction.
"L'addition syn - l'ajout d'un ou plusieurs substituants aux mêmes côtés de la double liaison - nécessitait un protocole de réaction différent mais toujours doux, " dit Hayato Miwa, deuxième auteur. « La portée du substrat alcène pour l'addition syn était large :nous avons même fusionné des composés hétéroaromatiques à travers la liaison. »
Une limitation commune des précédentes synthèses de diamines vicinales est la dernière étape :l'élimination des groupes protecteurs - des unités chimiques plutôt inertes qui masquent la chimie d'une ou plusieurs unités chimiques dans la molécule. Les groupes protecteurs empêchent les unités autrement réactives dans la molécule d'interférer avec la réaction en cours. Les chercheurs de l'Université d'Osaka ont découvert que l'élimination des groupes protecteurs des amines à la fin de leurs synthèses était simple.
"Les principaux sous-produits de notre protocole sont le chlorure de sodium et l'eau, " dit Minakata. " Nous faisons de notre mieux pour minimiser l'impact environnemental d'une réaction chimique importante. "
En utilisant l'iode moléculaire comme catalyseur, au lieu d'un métal toxique ou rare, Minakata et ses collègues font progresser la durabilité des synthèses pharmaceutiques pour les générations futures. Leur approche aidera également à minimiser les perturbations possibles de la chaîne d'approvisionnement en produits chimiques au cours de la pandémie en cours.