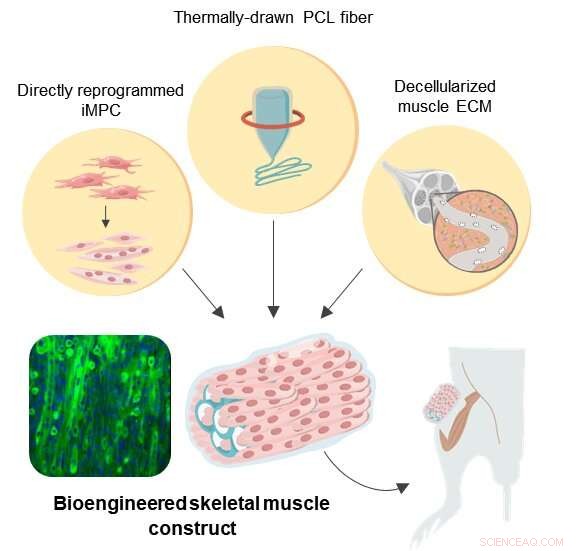
Illustration schématique des constructions bio-ingénieures de type muscle squelettique en 3D Crédit : Institute for Basic Science
Le muscle constitue le plus grand organe chez l'homme, représentant 40 % de la masse corporelle, et il joue un rôle essentiel dans le maintien de la vie. Le tissu musculaire est remarquable pour sa capacité unique de régénération spontanée. Cependant, dans les blessures graves telles que celles subies dans les accidents de voiture ou la résection tumorale qui entraîne une perte musculaire volumétrique (VML), la capacité du muscle à récupérer est fortement diminuée. Actuellement, Les traitements VML comprennent des interventions chirurgicales avec des lambeaux ou des greffes musculaires autologues accompagnées d'une thérapie physique. Cependant, les interventions chirurgicales entraînent souvent une diminution de la fonction musculaire, et dans certains cas, aboutir à un échec complet de la greffe. Ainsi, il existe une demande d'options thérapeutiques supplémentaires pour améliorer la récupération de la perte musculaire.
Une stratégie prometteuse pour améliorer la capacité fonctionnelle du muscle endommagé consiste à induire une régénération de novo du muscle squelettique via l'intégration de cellules transplantées. Divers types de cellules, y compris les cellules satellites (cellules souches musculaires), myoblastes, et les cellules souches mésenchymateuses, ont été utilisés pour traiter la perte musculaire. Cependant, biopsies musculaires invasives, faible disponibilité cellulaire, et une maintenance limitée à long terme entravent la traduction clinique, où des millions à des milliards de cellules matures peuvent être nécessaires pour apporter des bénéfices thérapeutiques.
Un autre problème important est de contrôler le microenvironnement tridimensionnel sur le site de la lésion pour s'assurer que les cellules transplantées se différencient correctement en tissus musculaires avec des structures souhaitables. Une variété de biomatériaux naturels et synthétiques ont été utilisés pour améliorer la survie et la maturation des cellules transplantées tout en recrutant des cellules hôtes pour la régénération musculaire. Cependant, il y a des non résolus, dilemmes durables dans le développement de l'échafaudage tissulaire. Les échafaudages naturels présentent une reconnaissance cellulaire et une affinité de liaison cellulaire élevées, mais échouent souvent à fournir une robustesse mécanique dans les grandes lésions ou les tissus porteurs qui nécessitent un soutien mécanique à long terme. En revanche, les échafaudages synthétiques offrent une alternative conçue avec précision avec des propriétés mécaniques et physiques réglables, ainsi que des structures et compositions biochimiques sur mesure, mais sont souvent entravés par le manque de recrutement cellulaire et une mauvaise intégration avec le tissu hôte.

Image SEM de l'échafaudage PCL poreux avec MEM Crédit :Institute for Basic Science
Pour surmonter ces défis, une équipe de recherche au Center for Nanomedicine au sein de l'Institute for Basic Science (IBS) à Séoul, Corée du Sud, Université Yonsei, et le Massachusetts Institute of Technology (MIT) a conçu un nouveau protocole pour la régénération musculaire artificielle. L'équipe est parvenue à un traitement efficace de la VML dans un modèle murin en utilisant une technologie de reprogrammation cellulaire directe en combinaison avec un échafaudage hybride naturel-synthétique.
Reprogrammation cellulaire directe, également appelée conversion directe, est une stratégie efficace qui fournit une thérapie cellulaire efficace car elle permet la génération rapide de cellules cibles spécifiques au patient en utilisant des cellules autologues de la biopsie tissulaire. Les fibroblastes sont les cellules que l'on trouve couramment dans les tissus conjonctifs, et ils sont largement impliqués dans la cicatrisation des plaies. Comme les fibroblastes ne sont pas des cellules différenciées en phase terminale, il est possible de les transformer en cellules progénitrices myogéniques induites (iMPC) en utilisant plusieurs facteurs de transcription différents. Ici, cette stratégie a été appliquée pour fournir iMPC pour l'ingénierie des tissus musculaires.
Afin de fournir un soutien structurel aux cellules musculaires en prolifération, polycaprolactone (PCL), a été choisi comme matériau pour la fabrication d'un échafaudage poreux en raison de sa haute biocompatibilité. Alors que la lixiviation au sel est une méthode largement utilisée pour créer des matériaux poreux, elle se limite le plus souvent à la réalisation de structures poreuses fermées. Pour surmonter cette limite, les chercheurs ont ajouté à la méthode conventionnelle de lixiviation du sel un étirage thermique pour produire des échafaudages en fibre PCL personnalisés. Cette technique a facilité la fabrication à haut débit de fibres poreuses à rigidité contrôlée, porosité, et des dimensions qui permettent une adaptation précise des échafaudages aux sites de blessure.
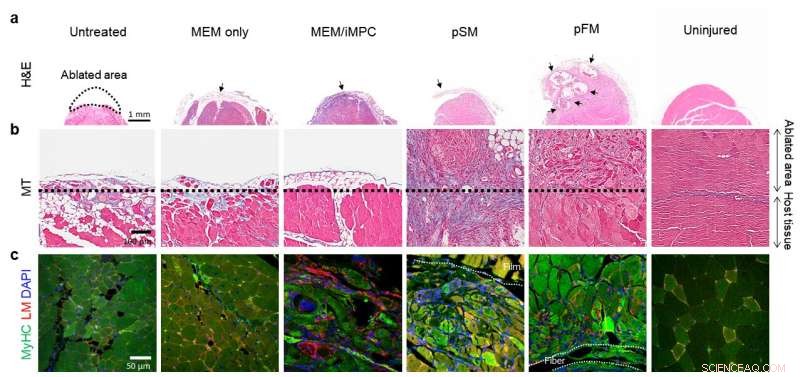
Recovery of the ablated muscle tissue a) 1 week and b-c) 4 weeks after transplantation Credit:Institute for Basic Science
Cependant, the synthetic PCL fiber scaffolds alone do not provide optimal biochemical and local mechanical cues that mimic muscle-specific microenvironment. Hence the construction of a hybrid scaffold was completed through the incorporation of decellularized muscle extracellular matrix (MEM) hydrogel into the PCL structure. Actuellement, MEM is one of the most widely used natural biomaterials for the treatment of VML in clinical practice. Ainsi, the researchers believe that hybrid scaffolds engineered with MEM have a huge potential in clinical applications.
The resultant bioengineered muscle fiber constructs showed mechanical stiffness similar to that of muscle tissues and exhibited enhanced muscle differentiation and elongated muscle alignment in vitro. Par ailleurs, implantation of bioengineered muscle constructs in the VML mouse model not only promoted muscle regeneration with increased innervation and angiogenesis but also facilitated the functional recovery of damaged muscles. The research team notes:"The hybrid muscle construct might have guided the responses of exogenously added reprogrammed muscle cells and infiltrating host cell populations to enhance functional muscle regeneration by orchestrating differentiation, paracrine effect, and constructive tissue remodeling."
Prof. Cho Seung-Woo from the IBS Center for Nanomedicine and Yonsei University College of Life Science and Biotechnology who led this study notes, "Further studies are required to elucidate the mechanisms of muscle regeneration by our hybrid constructs and to empower the clinical translation of cell-instructive delivery platforms."