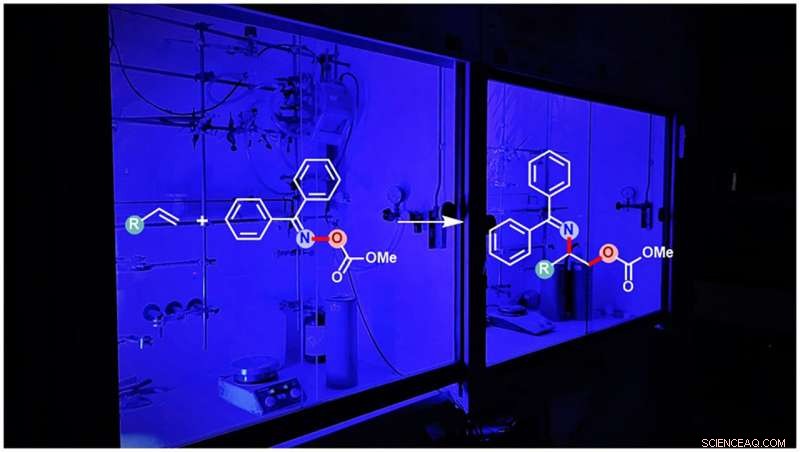
Synthèse photosensibilisée d'aminoalcools protégés. Crédit :WWU - Groupe Glorius
Que ce soit en bêta-bloquants pour traiter l'hypertension artérielle ou en produits naturels, Les aminoalcools dits vicinaux sont des composés organiques de haute qualité que l'on retrouve dans de nombreux objets du quotidien. Cependant, leur production est difficile, et depuis longtemps, les chimistes ont essayé de développer des méthodes efficaces pour les synthétiser. Dans leur étude récente publiée dans la revue Catalyse naturelle , des scientifiques dirigés par le professeur Frank Glorius de l'Université de Münster ont trouvé une solution pour la production d'une variante spéciale d'aminoalcools. "La nouvelle méthode permet d'étudier les propriétés de la substance et de trouver des applications pour ces nouveaux composés à l'avenir, " souligne Glorius de l'Institut de chimie organique de l'Université de Münster.
Les aminoalcools vicinaux peuvent se présenter sous deux variantes différentes, appelées régioisomères, dans lesquelles les groupes fonctionnels amine et alcool échangent des positions. Bien qu'ils soient donc très similaires, ils ont souvent des propriétés biochimiques différentes. L'installation des groupes amine et alcool en une seule étape pose un défi majeur. La découverte de la réaction d'hydroxylation aminée asymétrique avec laquelle l'un des régioisomères peut être produit a même abouti à un prix Nobel pour le chimiste Barry Sharpless en 2001. Cependant, l'autre régioisomère ne peut pas être synthétisé par une méthode similaire et est resté un problème de longue date - jusqu'à maintenant. Avec l'aide de la nouvelle méthode de réaction photo-initiée des chimistes, la synthèse de l'autre régioisomère est maintenant également devenue efficacement possible.
Les alcènes non activés contenant une double liaison carbone-carbone sont connus comme matières premières chimiques pour les processus de réaction en raison de leur bonne disponibilité. En général, l'installation des groupes amine et alcool en une seule étape via cette double liaison carbone-carbone d'alcène non activé est à tout moment initiée par le groupe amine, suivi de l'ajout du groupe alcool. Par conséquent, il se forme toujours un régioisomère particulier de l'aminoalcool vicinal. Maintenant, les scientifiques ont identifié une classe particulière de composés de type amine qui sont réactifs mais suffisamment stables pour permettre d'abord l'ajout du groupe alcool à la double liaison carbone-carbone, suivi de l'ajout du groupe amine pour générer le régioisomère opposé auparavant inaccessible des aminoalcools vicinaux.
"Comme les plantes utilisent la chlorophylle pour convertir la lumière en énergie, on utilise ce qu'on appelle un photocatalyseur, " explique le Dr Tuhin Patra, premier auteur de cette étude. "Cette espèce peut absorber la lumière des LED bleues et transférer son énergie dans une molécule directement impliquée dans la réaction. Cela libère simultanément les groupes amine et alcool." Ce processus, dans lequel les molécules se transfèrent des électrons, est appelé transfert d'énergie, explique le scientifique.
Fascinant, la nouvelle méthode génère le régioisomère le moins accessible des aminoalcools vicinaux de telle manière que les groupes alcool et amine sont protégés contre d'autres réactions. Selon les besoins de l'utilisateur, l'un des deux groupes alcool ou amine peut maintenant être réactivé sans affecter l'autre. Cependant, même les deux groupes peuvent être activés pour réagir davantage en même temps, si cela est nécessaire pour la synthèse d'autres exigences. "Les conceptions précédentes n'installent généralement qu'un seul groupe à la fois dans un processus global complexe en plusieurs étapes. Notre conception permet non seulement l'installation de deux groupes différents en une seule étape avec la protection souhaitée, mais génère également de manière fiable le régioisomère le moins accessible, offrant la possibilité d'étudier les applications futures de ce composé, " conclut Glorius.