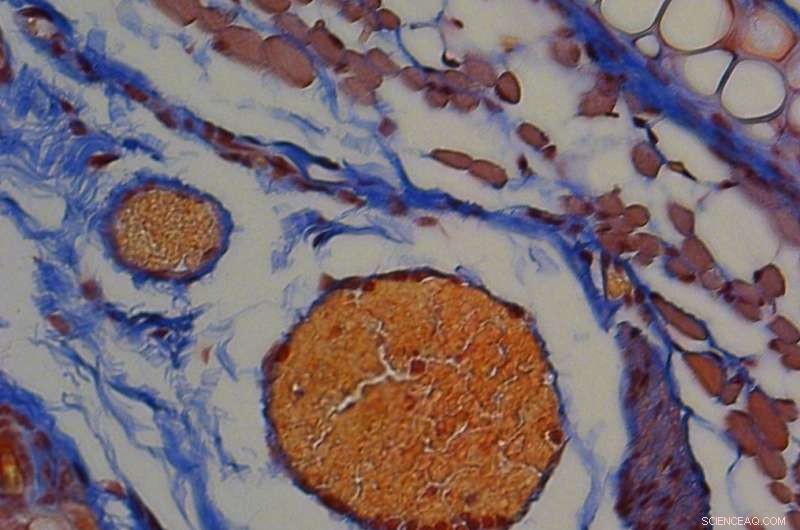
Un colorant rouge orangé montre que des caillots sanguins se sont formés dans une oreille de souris dans laquelle la thrombine a été libérée par les globules rouges déclenchés par la lumière. Barre d'échelle, 50 µm. Crédit :Adapté de ACS Science centrale 2020, DOI :10.1021/acscentsci.0c01151
Les thérapies protéiniques sont souvent plus puissantes et sélectives envers leurs cibles biochimiques que d'autres types de médicaments, molécules particulièrement petites. Cependant, les protéines sont également plus susceptibles d'être rapidement dégradées par les enzymes ou éliminées du sang par les reins, ce qui a limité leur utilisation clinique. Maintenant, chercheurs rapportant dans ACS Science centrale ont conçu des porteurs de globules rouges (RBC) qui libèrent des protéines thérapeutiques lorsqu'ils sont stimulés par la lumière, à l'aide d'un peptide d'abeille mellifère.
Parce que les médicaments à base de protéines sont instables dans le corps, ils doivent être donnés à des niveaux élevés, qui peut provoquer des effets secondaires. Les scientifiques ont essayé de protéger les thérapies protéiques de la dégradation en les encapsulant dans des supports, comme les liposomes, nanoparticules et globules rouges. Mais il a été difficile de faire en sorte que les transporteurs libèrent leur cargaison au lieu et au moment appropriés. Brianna Vickerman, David Lawrence et ses collègues voulaient concevoir des globules rouges pour libérer des protéines thérapeutiques dans des régions spécifiques du corps lorsqu'elles sont déclenchées par certaines longueurs d'onde de la lumière.
Les chercheurs ont intégré un peptide, appelé melittin, dans la membrane cellulaire des globules rouges. Un composant du venin d'abeille européenne, la mélittine provoque normalement la rupture des globules rouges. Mais l'équipe a modifié le peptide pour qu'il ne le fasse que lorsqu'il est illuminé par une longueur d'onde de lumière spécifique. Comme preuve de concept, les chercheurs ont chargé de la thrombine, une enzyme de coagulation du sang utilisée pour prévenir les saignements excessifs, dans les globules rouges modifiés et les ont injectés à des souris. Ils ont ensuite éclairé une petite région de l'oreille de chaque souris et examiné des sections du tissu.
L'analyse a montré une coagulation du sang liée à la thrombine uniquement sur les sites éclairés. La stratégie pourrait s'avérer utile pour la libération de protéines déclenchée par la lumière, thérapeutiques peptidiques et acides nucléiques à partir d'une variété de supports à base de lipides, disent les chercheurs.