
Images de cristaux de F420H2-oxydase obtenus en aérobie avec une taille typique de 0,1 mm. Avec l'oxygène, le Fe et la flavine à l'intérieur de l'enzyme donnent la couleur jaune naturelle aux cristaux. Crédit :Institut Max Planck de microbiologie marine/T. Wagner
Le méthane est un puissant gaz à effet de serre qui joue un rôle central dans le cycle mondial du carbone. À la fois, c'est une source d'énergie importante pour nous, les humains. Environ la moitié de sa production annuelle est constituée de micro-organismes appelés méthanogènes qui décomposent les matières organiques telles que les plantes mortes. Cela se produit normalement dans un habitat sans oxygène car ce gaz est mortel pour les méthanogènes. Mais même dans des habitats réellement dépourvus d'oxygène, des molécules d'oxygène apparaissent occasionnellement. Pour rendre ces intrus inoffensifs, Les méthanogènes possèdent une enzyme spéciale capable de convertir l'oxygène en eau.
« Les enzymes sont des composants vitaux du métabolisme de tous les organismes vivants et le but de notre laboratoire est de comprendre comment ces nanomachines fonctionnent au niveau moléculaire, " déclare Tristan Wagner du Max Planck Institute for Marine Microbiology et premier auteur de l'étude, publié dans la revue scientifique Communication chimique en septembre 2020. Pour l'étude, Wagner a cultivé un micro-organisme anaérobie appelé Methanothermococcus thermolithotrophicus, qui provient des sédiments du golfe de Naples. Il a purifié l'enzyme F420-oxydase, une protéine flavodiiron, et l'a cristallisé, une méthode courante pour étudier le fonctionnement des enzymes.
"On savait déjà que la F420-oxydase peut convertir l'oxygène en eau, " dit Wagner. " Mais nous avons réussi à décrypter le mécanisme. " L'étude est une coopération de scientifiques de l'Institut Max Planck de microbiologie marine, l'Institut Max Planck de Microbiologie Terrestre, l'Institut Paul Scherrer, l'Institut Interdisciplinaire de Recherche de Grenoble et l'Installation Européenne de Rayonnement Synchrotron.
L'oxygène est enfermé
Le mécanisme, les chercheurs ont révélé, a un besoin important :l'oxygène est très réactif, il est donc crucial que la réaction soit contrôlée correctement par l'enzyme et qu'aucun solvant ne flotte. Sinon, l'oxygène pourrait accidentellement se transformer en superoxyde et tuer l'anaérobie. L'astuce de l'enzyme F420-oxydase est d'utiliser un canal gazeux et un système de déclenchement. La molécule d'oxygène est d'abord canalisée dans le canal spécifique vers une cavité catalytique anhydre appropriée contenant du fer. Ensuite, le fer transforme l'oxygène en eau qui sera libérée par un mécanisme de déclenchement. Pour cela la cavité se met à bouger et ouvre une petite « porte ». Grâce au mouvement, l'eau nouvellement générée est transportée à l'extérieur. La cavité vide se referme et est disponible pour la prochaine molécule d'oxygène.
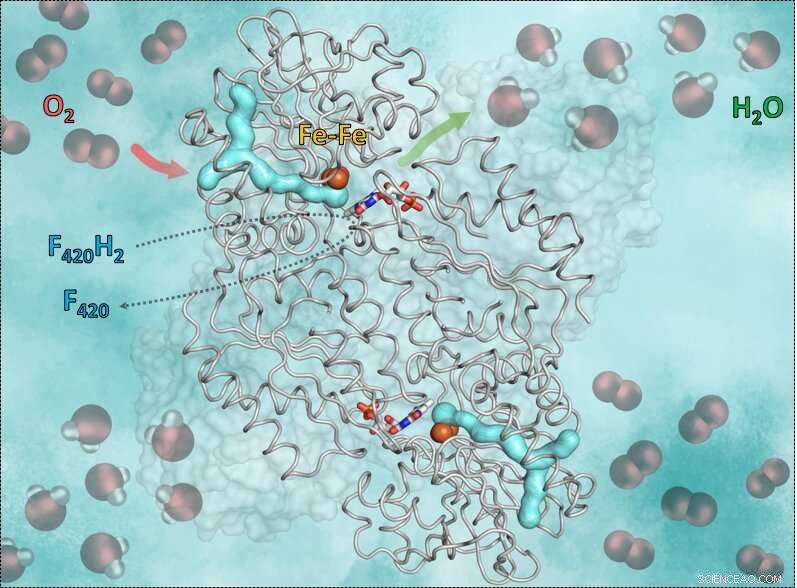
Ce graphique montre l'enzyme F420H2-Oxidase et son fonctionnement. La partie en forme de y cyan est le canal de gaz. La flèche rouge indique le chemin de l'oxygène vers la cavité catalytique contenant du fer. La flèche verte symbolise la sortie de l'eau. Encore, les bâtons bleu-rouge au milieu montrent la flavine (FMN) acceptant les électrons de la coenzyme réduite F420, qui apporte l'hydrogène nécessaire pour transformer l'oxygène en eau. Crédit :S. Engilberge et T. Wagner
Pour mieux comprendre ce mécanisme, les scientifiques ont utilisé la cristallographie aux rayons X. Ils ont d'abord obtenu la structure cristalline sans oxygène, où ils pouvaient voir la cavité catalytique anhydre isolée du solvant. Puis, ils ont gazé les cristaux d'enzyme avec le gaz inerte krypton, lequel, contrairement à l'oxygène, peut être rendu visible par les rayons X. Ensuite, ils ont irradié les cristaux d'enzymes et ont pu détecter des atomes de krypton montrant le canal de gaz menant à la cavité catalytique. La protéine flavodiiron et son canal sont conservés non seulement dans les méthanogènes, mais aussi dans d'autres micro-organismes comme les clostridies (qui vivent principalement dans le sol ou dans le tube digestif), dans la bactérie soufrée Desulfovibrio gigas ou encore dans le parasite intestinal Giardia intestinalis.
Le plus vite le mieux
"Cette réaction est vraiment rapide, " explique Sylvain Engilberge de l'Institut Paul Scherrer et premier auteur de l'étude aux côtés de Tristan Wagner. " Cette vitesse est également la grande importance de notre enquête. Des enzymes similaires comme la laccase sont beaucoup plus lentes. " Pour une future application de l'électrochimie bio-inspirée processus, nous devons apprendre davantage de la réaction chimique, structure et fonction de différents groupes d'enzymes réductrices d'oxygène, ", explique Engilberge. Cela ouvrirait également la voie à l'ingénierie des protéines pour convertir un détoxifiant O2 à haut débit en un puits d'électrons pour les processus industriels.
"Notre prochaine étape serait de comprendre la diversité de la protéine flavodiiron, " dit Tristan Wagner. Certains homologues ne ciblent pas l'oxygène mais le monoxyde d'azote toxique, leurs enzymes peuvent faire la distinction entre les deux gaz avec une spécificité élevée. Mais qu'est-ce que le filtre sélectif ? Le canal du gaz ? L'environnement de la cavité catalytique ? "Plus d'études doivent être menées pour comprendre comment la protéine discrimine l'oxygène et l'oxyde nitrique, " ajoute Wagner. Avec une telle connaissance, il serait par exemple possible de prédire à partir d'informations génomiques si une protéine flavodiiron serait un piégeur d'oxygène ou d'oxyde nitrique.