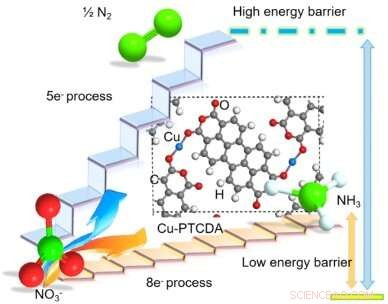
Structure proposée de PTCDA Cu-incorporé et diagramme schématique illustrant son avantage de réduire sélectivement le NO3− en NH3 via un transfert direct de 8 électrons. Rouge, blanche, gris, Bleu brillant, et les sphères vertes représentent le O, H, C, Cu, et N atomes, respectivement. Crédit :Chen et al.
Ammoniac (NH
Alors que le procédé Haber-Bosch permet la production en masse d'ammoniac, il est connu pour être nocif pour l'homme et l'environnement, car elle entraîne la consommation d'énergies fossiles et aggrave ainsi l'effet de serre. En raison de ces effets indésirables, les chercheurs ont cherché des méthodes alternatives pour produire de l'ammoniac via N
Certaines de ces nouvelles techniques de production d'ammoniac se sont révélées efficaces et relativement peu coûteuses. Néanmoins, ils ne permettaient généralement aux chercheurs que de produire des quantités limitées d'ammoniac et présentaient une mauvaise sélectivité, en raison de la liaison inerte N≡N et de la solubilité ultra-faible de N
Des chercheurs de l'Université de technologie de Chine du Sud et du Laboratoire national d'Argonne ont récemment mis au point une nouvelle stratégie électrochimique pour produire de l'ammoniac grâce à la réduction des nitrates. Leur méthode, présenté dans un article publié dans Énergie naturelle , est basé sur l'utilisation d'un catalyseur solide moléculaire de cuivre.
"Obtenir NH
Conversion sélective NON
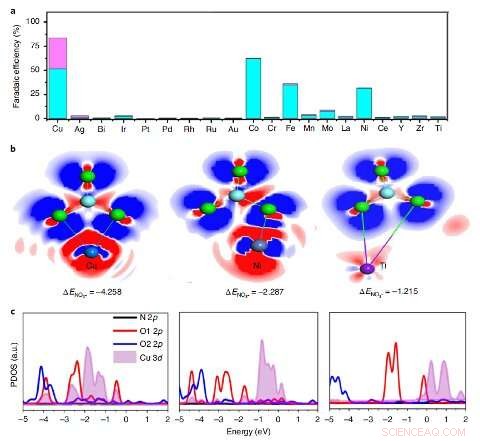
Dépistage de l'élément ayant la plus forte activité. une, L'efficacité faradique du NH3 (bleu) et du NO2− (mauve) de divers éléments incorporés dans le PTCDA sous un potentiel de -0,4 V versus RHE. b, L'EDD de NO3– sur 1Cu–PTCDA(¬103) (gauche), 1Ni–PTCDA(¬103) (au centre) et 1Ti–PTCDA(¬103) (à droite). Bleu, bleu foncé, violet, les sphères bleu ciel et vertes représentent le Cu, Non, Ti, atomes de N et O, respectivement. Le nuage électronique bleu indique l'accumulation de charge et le nuage électronique rouge indique l'épuisement de la charge. c, La densité d'états projetée (PDOS) de *NO3 sur 1Cu–PTCDA (¬103) (à gauche), 1Ni–PTCDA(¬103) (au centre) et 1Ti–PTCDA(¬103) (à droite). Crédit :Chen et al.
"Conversion NON
Le potentiel pratique de la conversion du NO
Dans leur étude, Wang et ses collègues ont pu réaliser la réduction directe de huit électrons du NO
"Nous avons criblé des catalyseurs avec la préparation d'une série de métaux incorporés dans PTCDA, comme Cu, Ag, Au, Ru, Rh, Je, Pd, pt, Bi, Ti, Cr, Mn, Fe, Co, Non, Oui, Zr, Mo, La et Ce, " a expliqué Wang. " Nous avons constaté que la haute performance de notre catalyseur peut être attribuée à la configuration électronique unique de Cu 3 ré orbitale montrant un chevauchement accru avec le nitrate O 2 p orbitales pour améliorer le transfert de charge, ainsi que la structure de PTCDA, qui aide à réguler le transfert de protons et d'électrons vers les centres Cu actifs, puis à inhiber HER et à favoriser la liaison H-N."
La méthode électrochimique introduite par Wang et ses collègues pourrait relever les défis actuellement associés au NH de masse
Les résultats sont nettement meilleurs que ceux obtenus en utilisant d'autres méthodes de réduction électrochimique de N
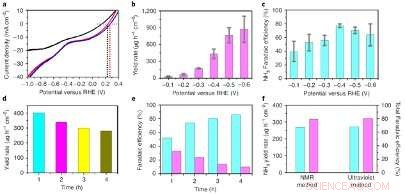
Performances électrocatalytiques de l'O-Cu–PTCDA. une, Courbes de voltamétrie à balayage linéaire de O-Cu-PTCDA testées dans 0,1 M de PBS (noir), 0,1 M de PBS contenant du NO2− (rouge) et 0,1 M de PBS contenant du NO3− (bleu). b, Taux de rendement de NH3 à différents potentiels à la deuxième heure. c, Efficacité faradique du NH3 à différents potentiels à la deuxième heure. ré, Taux de rendement de NH3 à différents instants à -0,4 V versus RHE jusqu'à 4 h. e, NH3 (blue) and NO2− (mauve) Faradaic efficiencies at different times at −0.4 V versus RHE up to 4 h. F, The overall NH3 yield rate (blue) and total Faradaic efficiency (mauve) detected by 1H NMR spectroscopy and an indophenol blue method after the 4-h experiment. Credit:Chen et al.
The recent study by Wang and his colleagues also opens up new possibilities for the recycling of nitrogen (NO
"The total nitrogen discharged into the water per year is 14.5 ± 3.1 million tons in China, which is about 50% of the annual consumption of synthetic nitrogen (300.5 million tons in 2016), " Wang said. "In 2016, the United States planted 94 million acres of corn, using about 8.9 billion kilograms of nitrogen annually, which accounts for 40% of the annual nitrogen use in the United States. Cependant, it is worth noting that 2.4 billion kilograms of nitrogen is available in wastewater each year.
The statistics prove that nitrogen in wastewaters could be a valuable resource."
In addition to allowing the large-scale production of ammonia in ways that are more environmentally friendly, the recent work by Wang and his colleagues could pave the way toward the development of wastewater management systems with nitrogen conversion capabilities. These systems would enable the recycling of large quantities of nitrogen, ultimately optimizing the use of global resources and protecting the environment.
While the results are promising, the researchers still need to overcome two technical challenges before their method can be applied in real-world settings. These challenges will be the main focus of their next set of studies.
"D'un côté, our future studies will be aimed at enhancing the catalyst's structure to further improve its long-term stability, " Wang said. "In this work, the NH
© 2020 Réseau Science X