Crédit :Université de Cambridge
Les chercheurs ici ont mis au point une stratégie pour rendre une réaction chimique catalysée par un métal de transition énantiosélective grâce à l'utilisation d'un cation chiral. Le travail a été effectué dans le groupe de recherche du Dr Robert Phipps.
Précédemment, Robert dit, alors que les cations chiraux ont été largement utilisés comme organocatalyseurs, les amener dans des réactions chimiques catalysées par des métaux de transition pour contrôler l'énantiosélectivité de la réaction a été beaucoup plus rare. Maintenant, après deux ans de travail acharné " et beaucoup d'efforts d'équipe, " ils y sont parvenus.
Leur travail, Publié dans Science , est "essentiellement une preuve de concept que vous pouvez faire cela, et que cela peut être fait sur un type de réaction difficile qui s'est avéré difficile avec les approches existantes, " il dit.
Le groupe Phipps développe des méthodologies pour la synthèse de petites molécules, comme les médicaments. Dans les dernières années, ils ont consacré des efforts considérables au développement de catalyseurs capables de contrôler la sélectivité positionnelle dans les réactions chimiques, c'est-à-dire contrôler exactement à quel point de la molécule la réaction chimique a lieu. Ils l'ont fait en développant des ligands pour les catalyseurs de métaux de transition qui ancrent le catalyseur à une position particulière sur la molécule.
Et ils ont cherché des moyens d'affiner encore plus les ligands, de sorte qu'ils soient capables de les rendre non seulement positionnellement sélectifs mais aussi énantiosélectifs. Les énantiomères sont des images miroir - comme une main gauche et une main droite - d'une molécule. Pouvoir sélectionner lequel des deux énantiomères de la molécule ils produisent, et donc de quel type de « maniabilité » il a, C est la clé.
Car tandis qu'un énantiomère de la molécule peut produire l'effet thérapeutique souhaité, l'autre énantiomère peut soit ne produire aucun effet, ou peut entraîner des effets secondaires indésirables. En outre, la chiralité, ou 'l'habilité, " de l'énantiomère peut être vital pour assurer la précision de la façon dont il interagit au sein d'un système biologique.
"La nature elle-même présente la chiralité de plusieurs manières. Les protéines sont formées de blocs de construction d'acides aminés qui existent naturellement sous forme d'un énantiomère, c'est-à-dire qu'ils sont à une main. De plus, l'ADN possède une chiralité hélicoïdale, " explique Robert. " Donc, en tant que chimistes de synthèse, il est vraiment important que nous soyons capables de fabriquer de petites molécules sous forme d'énantiomères uniques. Quand nous allons mettre une petite molécule dans un système biologique où nous espérons qu'elle aura, par exemple, un effet thérapeutique, l'énantiomère « gauche » pourrait s'intégrer assez différemment par rapport à l'énantiomère « droite ».
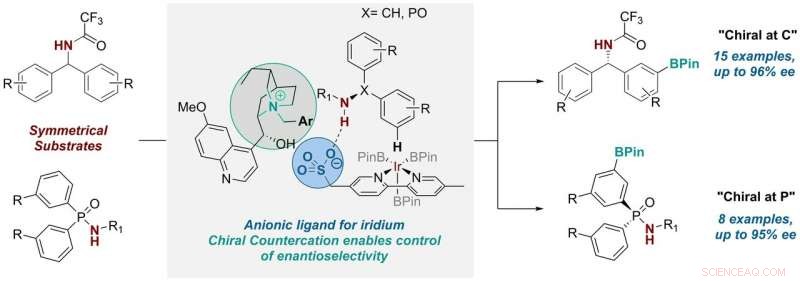
Il y a trois ans, le groupe a développé un ligand pour les catalyseurs de métaux de transition qui contrôlait la sélectivité positionnelle dans une réaction d'activation C-H, une réaction utile largement utilisée dans l'industrie pharmaceutique et généralement obtenue à l'aide d'une catalyse aux métaux de transition. Ils l'ont fait en prenant un échafaudage de ligand bipyridine commun et en y attachant un groupe sulfonate anionique.
Après avoir attaché ce groupe anionique (ou chargé négativement) à l'échafaudage, ils avaient alors besoin d'un composant chargé positivement pour l'équilibrer. Dans leurs précédents travaux, les chercheurs ont utilisé un cation ordinaire (tétrabutylammonium) pour ce rôle, qui était initialement juste pour assurer la solubilité du sel dans les solvants organiques. Mais ils se sont rendu compte que "nous avons eu l'opportunité d'introduire ici un cation chiral qui pourrait potentiellement être impliqué dans l'état de transition de la réaction et exercer une certaine influence sur celui-ci, " explique Robert. Ils ont donc cherché à savoir si cela était possible.
doctorat l'étudiant Georgi Genov a d'abord travaillé sur l'idée, qui a finalement impliqué deux autres doctorats. étudiants, James Douthwaite et David Gibson, et chercheur postdoctoral, Antti Lahdenperä. Ils ont remplacé le cation tétrabutylammonium achiral par un cation chiral dérivé de la quinine antipaludique naturelle. Et ce faisant, ils ont découvert qu'ils étaient capables de contrôler non seulement la sélectivité positionnelle mais aussi l'énantiosélectivité dans la réaction, qui remplace la liaison C-H sur un cycle aromatique par une liaison C-B polyvalente.
Georgi déclare :« Le processus d'optimisation de cette transformation a été assez complexe. Cependant, après avoir découvert les bonnes conditions de cation et de réaction, nous avons observé que le système était remarquablement général, nous permettant d'utiliser deux classes de substrats très différentes, l'une où le nouveau stéréocentre se trouve à un atome de carbone, et un où il est au phosphore. Ce dernier est très excitant car la synthèse de chiraux au niveau des composés du phosphore est plus difficile."
Jusqu'ici, il y a eu des moyens très bien établis de faire des réactions énantiosélectives avec des métaux de transition - mais ils reposent normalement sur l'introduction d'une sorte de chiralité directement dans l'échafaudage du ligand attaché au métal et "il peut y avoir des inconvénients à cette approche qui signifie qu'elle ne fonctionnera pas dans certaines situations, " dit Robert.
"Nous savons que ces cations chiraux, du type que nous utilisons, sont vraiment privilégiés car ils ont été utilisés dans d'autres types de catalyse asymétrique. Mais ils n'ont pratiquement pas été utilisés avec les métaux de transition. Donc, si nous pouvions potentiellement unir ces cations chiraux privilégiés avec des métaux de transition réactifs, alors peut-être avons-nous une façon nouvelle et assez différente de penser à la catalyse asymétrique des métaux de transition. »
Il ajoute :« Nous sommes ravis d'envisager d'étendre cela à d'autres réactions catalysées par des métaux de transition vraiment utiles où des défis existent pour les exécuter de manière énantiosélective. Plus précisément, nous aimerions voir si nous pouvons permettre des réactions énantiosélectives qui n'étaient pas possibles auparavant, en utilisant cette stratégie."