Crédit :Wiley
L'état de repliement des protéines dans les cellules vivantes reflète souvent la santé générale de la cellule. Des scientifiques australiens ont développé une sonde moléculaire qui détecte l'état du protéome - l'ensemble des protéines - en mesurant la polarité de l'environnement protéique. Le signal de fluorescence de la sonde quantifie le dépliement et son changement de couleur de type caméléon cartographie les régions cellulaires de mauvais repliement amélioré, selon l'étude publiée dans la revue Angewandte Chemie .
Si les cellules vivantes sont stressées, les mécanismes de synthèse des protéines et de correction du repliement sont déséquilibrés. Les protéines mal repliées restent collées, une dégradation accrue se produit, et les protéines inactives et les débris de protéines s'agrègent pour former des granules et des condensats dans le cytoplasme. De tels agrégats jouent un rôle important dans les maladies neurodégénératives et le cancer. L'un des facteurs déterminants de l'agrégation de protéines mal repliées semble être la polarité, c'est-à-dire la distribution électronique dans un environnement. Yuning Hong et ses collègues de l'Université La Trobe de Melbourne et de l'Université de Melbourne, Australie, ont conçu une sonde fluorogène bimodale pour surveiller l'agrégation des protéines plus en détail.
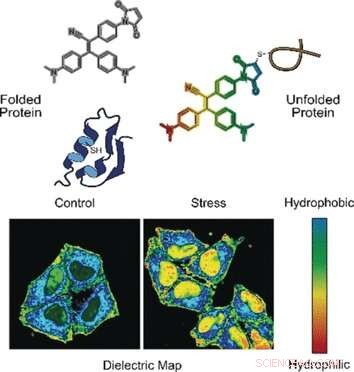
Dans un seul mode, la sonde détecte les protéines mal repliées. Les protéines correctement repliées sont souvent stabilisées par des ponts constitués de l'acide aminé cystéine. Ces ponts sont généralement profondément enfouis, tandis que les protéines mal repliées exposent les résidus de cystéine à la surface. Lorsque la sonde se lie à la cystéine exposée par une chaîne protéique mal repliée, la fluorescence est allumée, expliquent les auteurs.
Dans l'autre mode, la sonde évalue la polarité. Les environnements polaires indiquent une distribution électronique déséquilibrée, qui peut être mesurée par la constante diélectrique. Pour mesurer ce paramètre, les chercheurs ont ajouté un groupe chimique électronique "push-pull" à la sonde fluorogène. Ils ont observé que, dans les solutions polaires à constante diélectrique élevée, la sonde fluorogène appelée NTPAN-MI a émis son signal de fluorescence avec un décalage de couleur. Ce changement de couleur « caméléon » indique donc un changement de polarité.
Les auteurs ont testé la sonde NTPAN-MI sur une lignée cellulaire humaine, qu'ils ont souligné en ajoutant des médicaments qui interféraient avec la synthèse et le repliement des protéines. Les scientifiques ont observé une fluorescence normale dans les cellules non traitées, mais une fluorescence brillante lorsque les protéines dépliées ou mal repliées se sont accumulées dans des cellules traitées avec des toxines ou infectées par un virus. En outre, le changement de couleur signalait la polarité de l'environnement et donc l'état du protéome de chaque compartiment cellulaire. Les chercheurs ont rapporté avoir visualisé pour la première fois la « charge protéique dépliée » dans le noyau. Les méthodes précédentes ne pouvaient mesurer que les protéines dépliées dans le cytoplasme.
Avec ses deux modes de détection, mesurant le dépliement et la polarité de l'environnement protéique, la sonde NTPAN-MI fournit une image plus précise des réponses au stress des cellules vivantes que ce qui peut être obtenu avec des sondes monomodales ou différentes méthodes. Les auteurs soulignent que leur méthode permettrait aux scientifiques d'obtenir une connaissance plus précise de la diaphonie des composants cellulaires en réponse au stress.