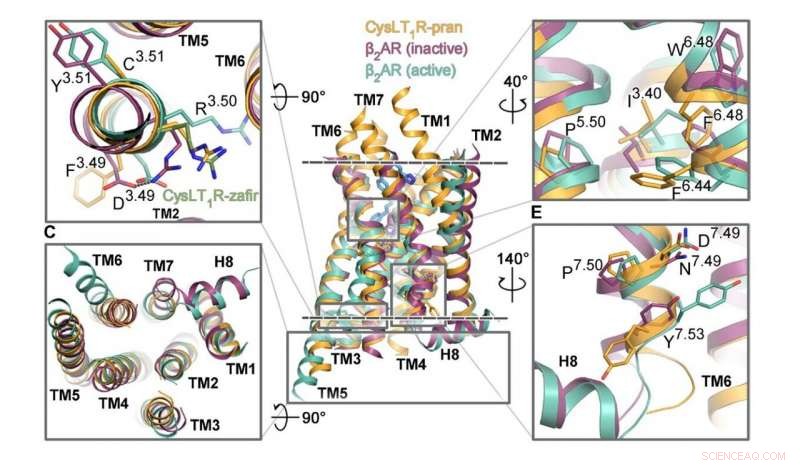
Les segments du récepteur CysLT1 responsables de son activation sont représentés en orange, à côté d'autres récepteurs couplés aux protéines G. Crédit :Luginina et al./Science Advances
Une équipe de recherche du MIPT Center for Molecular Mechanisms of Aging and Age-Related Diseases a collaboré avec des collègues des États-Unis, Canada, La France, et l'Allemagne pour déterminer la structure spatiale du récepteur CysLT1. Le document a été publié en Avancées scientifiques .
récepteurs couplés aux protéines G, ou GPCR, sont des machines moléculaires incorporées dans les membranes cellulaires. Ces récepteurs captent des signaux spécifiques à l'extérieur d'une cellule et les transmettent dans la cellule. Les signaux proviennent de diverses sources, y compris les photons de lumière, molécules de graisse, petites protéines, et des fragments d'ADN. Un GPCR peut déclencher divers événements dans la cellule, comme la division, déménagement, voire la mort.
La « communication » cellulaire médiée par GPCR est cruciale pour le fonctionnement d'un organisme. Pas étonnant que ces récepteurs soient d'une manière ou d'une autre impliqués dans tous les processus de notre corps. Ils sont la cible d'environ 40 % des médicaments existants, trop. Ainsi, il est intéressant pour les biologistes structuraux de comprendre le mécanisme de fonctionnement de ces machines biologiques et de trouver un moyen de les affecter, en développant de nouveaux médicaments qui possèdent plus de spécificité et moins d'effets secondaires.
La biologie structurale est un domaine transversal à l'interface de la physique et de la biologie, concernés par l'étude de l'arrangement 3-D des macromolécules biologiques, comme les protéines. Les études structurales impliquent le génie génétique, production de protéines artificielles, purification, et cristallisation. Une fois le cristal de protéine obtenu, la physique entre en jeu :les chercheurs exposent le cristal de protéine à de puissants rayons X pour générer des schémas de diffraction. Les données résultantes peuvent être traitées mathématiquement pour récupérer une structure atomique 3D détaillée d'une molécule de protéine donnée, avec une précision allant jusqu'à plusieurs angströms.
Les études structurelles reposent sur de puissantes sources de rayons X. Ceux-ci sont généralement de deux sortes :les synchrotrons et les lasers à électrons libres plus récemment développés. Dans les deux cas, les électrons sont accélérés à presque la vitesse de la lumière. Ils sont alors obligés de changer de vitesse ou de sens de déplacement, conduisant à l'émission de rayons X. Dans un synchrotron, les électrons se déplacent le long d'une courbe, trajectoire presque circulaire. Dans un laser à électrons libres, ils parcourent un passage entre deux rangées d'aimants alternés de sens opposés, connu comme un onduleur.
Alors que les biologistes structurels utilisent les synchrotrons depuis les années 1970, les lasers à électrons libres sont un ajout relativement récent à la boîte à outils de cristallographie des protéines. Introduit au début des années 2010, ils génèrent un rayonnement extrêmement puissant et permettent l'analyse par diffraction des rayons X de minuscules cristaux de 1 micromètre. Ce nouvel instrument a déjà permis la découverte de plusieurs centaines de structures.
Des chercheurs du MIPT ont étudié la structure d'un GPCR connu sous le nom de CysLT1. Il est impliqué dans les processus inflammatoires et joue un rôle important dans les maladies allergiques, y compris l'asthme, qui touche environ 10 % de la population mondiale. L'équipe de biophysiciens a obtenu la structure 3-D détaillée du récepteur avec les molécules de zafirlukast et de pranlukast. Ce sont deux médicaments prescrits aux patients asthmatiques, rhinite allergique, et l'urticaire.
Bien que relativement grand, Des cristaux de 0,3 millimètre avec du pranlukast ont été cultivés dans l'étude, les cristaux de zafirlukast n'atteignaient que quelques micromètres. Les premiers échantillons ont été étudiés au synchrotron ESRF de Grenoble, La France. Ces derniers ont été examinés à l'aide de la source de lumière cohérente Linac exploitée par l'université de Stanford, un laser à électrons libres. Les collègues des chercheurs du Canada ont aidé à explorer les mécanismes de transmission du signal via CysLT1.
"Ce sont sans doute des structures uniques, et nous les aimons beaucoup, " a déclaré Aleksandra Luginina, co-auteur de l'étude du laboratoire MIPT de biologie structurale des récepteurs couplés aux protéines G. " Le mécanisme de fonctionnement du récepteur CysLT1 met à jour la façon dont nous voyons le fonctionnement des sous-groupes de protéines GPCR. Aussi, en identifiant les sites de liaison des molécules de zafirlukast et de pranlukast, nous posons les bases de l'amélioration des médicaments contre l'asthme, en augmentant leur efficacité et en réduisant les effets secondaires. »
Les GPCR sont des objets notoirement difficiles pour les études structurelles. Seule une poignée de laboratoires dans le monde ont réussi à mener à bien des projets de recherche de ce type. L'équipe du MIPT se réjouit qu'un laboratoire de l'Institut soit désormais parmi eux.