
Le Dr Ohkanda détient le composé stratégiquement conçu pour s'accrocher dans le trou de l'enzyme. Crédit :Junko Ohkanda Ph.D., Professeur d'Assemblée Académique, Institut d'agriculture, Université de Shinshu
"La stratégie était de concevoir le médicament pour pouvoir s'accrocher dans le trou de la FTase et de la GGTase I, sinon la surface des protéines est trop grande et glissante, " Le Dr Junko Ohkanda de l'Université de Shinshu explique sa stratégie derrière son article choisi par Chimie—Une revue européenne comme un « Papier chaud ».
Les sociétés pharmaceutiques du monde entier tentent de concocter un médicament efficace pour cibler les protéines K-Ras depuis 20 à 30 ans. Lorsque les protéines K-Ras mutent, ils font que l'interrupteur de multiplication reste allumé en permanence, devenir une forme de cancer agressive et incurable. Dans 90 à 100 % des cancers difficiles du poumon et du pancréas, K-Ras jouerait un rôle. 30% de tous les cancers auraient une forme de mutation Ras.
Les scientifiques ont eu du mal à concevoir un médicament pour infiltrer K-Ras en raison d'un manque de poches interactives. Une nouvelle stratégie a été conçue pour attaquer la FTase, une enzyme importante dans la modification lipidique du K-Ras. Sans FTase, le K-Ras muté serait incapable de se multiplier de manière incontrôlable. Les scientifiques ont développé un grand nombre d'inhibiteurs de la FTase, mais a eu du mal à désactiver la modification K-Ras.
Même lorsque la FTase était inhibée, Les modifications du K-Ras n'ont pas été arrêtées car la GGTase I réagissait également avec le K-Ras, malgré sa cavité réactive différente. On n'a pas compris pourquoi, jusqu'à ce que son mécanisme soit élucidé, la FTase et la GGTase I sont toutes deux constituées de deux parties protéiques, dont l'un est le même, avec exactement le même ADN.
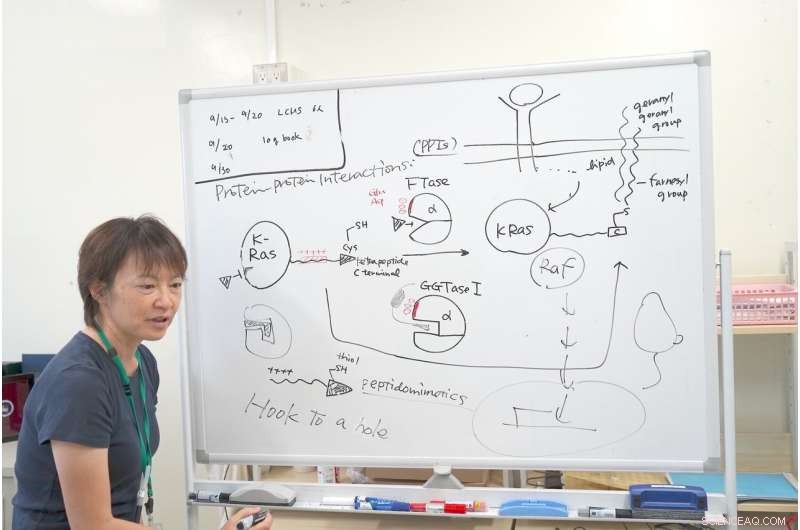
Le Dr Ohkanda explique le mécanisme de sa recherche avec K-Ras. Crédit :Junko Ohkanda Ph.D., Professeur d'Assemblée Académique, Institut d'agriculture, Université de Shinshu
Près de la cavité activée, la FTase et la GGTase I ont le même groupe d'acides aminés acides, comme l'acide glutamique et l'acide aspartique, portant une charge négative. En observant de près l'extrémité C-terminale de K-Ras, il avait une charge positive interactive. D'autres protéines Ras n'ont pas cette zone chargée positivement. Seul K-Ras a ce groupe de charges positives. C'est pourquoi même si la FTase était inhibée, les K-Ras réagissaient toujours avec la GGTase I, même si sa cavité était différente.
C'est là que le Dr Ohkanda a eu son moment d'inspiration. En théorie, la poche de l'enzyme et la clé de cystine s'attachent et se rejoignent. Mais dans ce cas, les surfaces des protéines, avec le plus et le moins interagissent également. Même si la FTase est inhibée, le K-Ras a interagi par erreur avec la GGTase I. Le Dr Ohkanda et ses collègues pensaient qu'avec un composé, ils pourraient exercer deux fonctions.
La stratégie était de concevoir une molécule pour imiter la partie du K-Ras qui agit sur la poche active ainsi que sur la surface acide. Il va sans dire que la fonction du médicament doit se produire à l'intérieur de la cellule. Les grosses molécules utiles dans les interactions protéine-protéine sont souvent trop grosses pour pénétrer à l'intérieur de la cellule. C'est un problème qui énigme de nombreux développeurs de médicaments :les méthodes d'administration.
Le Dr Ohkanda a pensé que si elle pouvait concevoir rationnellement le thiol à l'extrémité du K-Ras pour s'accrocher à la poche active de la FTase et de la GGTase I, la portion de charge positive interactive étendue pourrait interagir et pénétrer la membrane cellulaire. Si la portion de cystéine pouvait s'accrocher dans la cavité, la chaîne positive interactive connectée peut être petite et délivrée stratégiquement à la surface acide des enzymes. Il était difficile de minimiser la taille du composé tout en augmentant sa stabilité et en conservant sa capacité de réactions chimiques. En utilisant un peptidomimétique de même longueur et de même clé, ils ont réussi à pénétrer dans la cellule in vitro, perturbant la multiplication galopante de K-Ras.
D'autres études sont nécessaires pour augmenter l'activité du composé, tester in vivo et évaluer sa toxicité bien avant que le composé puisse être utilisé comme traitement contre les cancers. Le Dr Ohkanda continue de travailler avec une équipe internationale d'experts pour élucider le mécanisme d'action et leurs interactions afin de concevoir rationnellement des médicaments efficaces pour arrêter la multiplication de ces cellules.