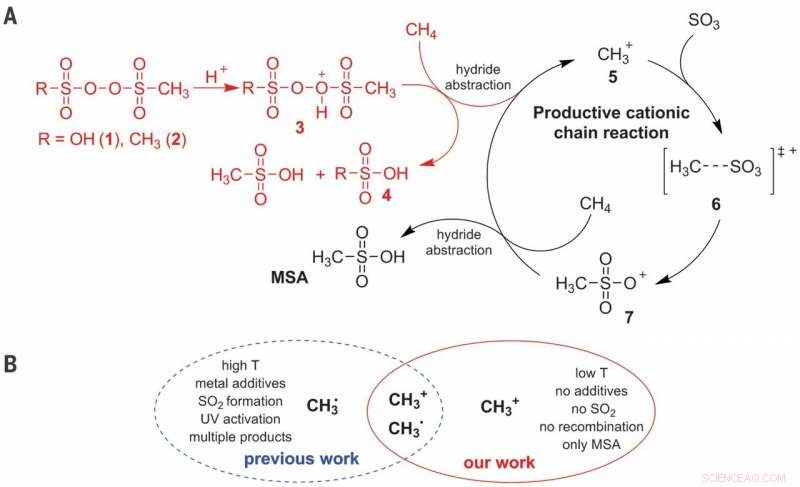
(A) Mécanisme de réaction ionique proposé pour l'activation C-H de CH4 dans la production sélective de MSA (acide méthanesulfonique). (B) Avantages de la voie cationique par rapport à la voie radicalaire. T, Température. Crédit :Sciences, doi:10.1126/science.aav0177
Le méthane est un composant majeur du gaz naturel et l'une des molécules les plus difficiles à activer de manière contrôlée, puisque la plupart du produit génère du dioxyde de carbone. La conversion industrielle du méthane en dérivés d'alcool est généralement basée sur une voie détournée qui commence par une suroxydation en monoxyde de carbone. Bien que des approches plus directes se soient révélées prometteuses dans des milieux très acides à petite échelle, ils ne sont pas tout à fait rentables. Dans une étude récente maintenant publiée dans Science , Christian Díaz-Urrutia et Timo Ott du département R&D de Grillo-Werke AG Company décrivent une réaction à l'échelle d'une usine pilote qui combinait directement le méthane (CH
La fonctionnalisation directe du méthane pour former des produits à valeur ajoutée est un défi en raison de la suroxydation potentielle dans de nombreux environnements de réaction et la sulfonation est une approche attrayante pour atteindre la sélectivité d'intérêt. Dans le processus pratique, Díaz-Urrutia et Ott ont produit de l'acide méthanesulfonique (MSA) en utilisant seulement deux réactifs principaux; le méthane et le trioxyde de soufre. Ils ont atteint 99 pour cent de sélectivité et de rendement de MSA dans le travail. Les scientifiques ont basé l'initiateur électrophile sur un dérivé de peroxyde de sulfonyle, qu'ils ont protoné dans des conditions superacides pour produire un atome d'oxygène hautement électrophile capable d'activer une liaison C-H du méthane. Ils ont proposé des études mécanistiques pour soutenir la formation d'un cation méthénium (CH
Alors que les techniques de fracturation à grande échelle et la production de biogaz ont permis d'accéder à de grandes quantités de méthane inactif, la plus grande transformation chimique du méthane reste confinée aux procédés Fischer-Tropsch très exigeants en énergie. Maintenant, le méthane est transformé industriellement en gaz de synthèse, un mélange de monoxyde de carbone et d'hydrogène, pour former des produits utiles, notamment du méthanol et des hydrocarbures Fischer-Tropsch, qui sont synthétisés dans les étapes suivantes. La production de gaz de synthèse est fortement limitante des coûts, toutefois; Les usines "MegaMethanol" ou le complexe perlé Fischer-Tropsch au Qatar dépassent les 10 millions de tonnes métriques (MT) de la production annuelle totale d'hydrocarbures. Par conséquent, la conversion directe du méthane en produits de valeur sur une technique économiquement viable sont d'un intérêt extrême.
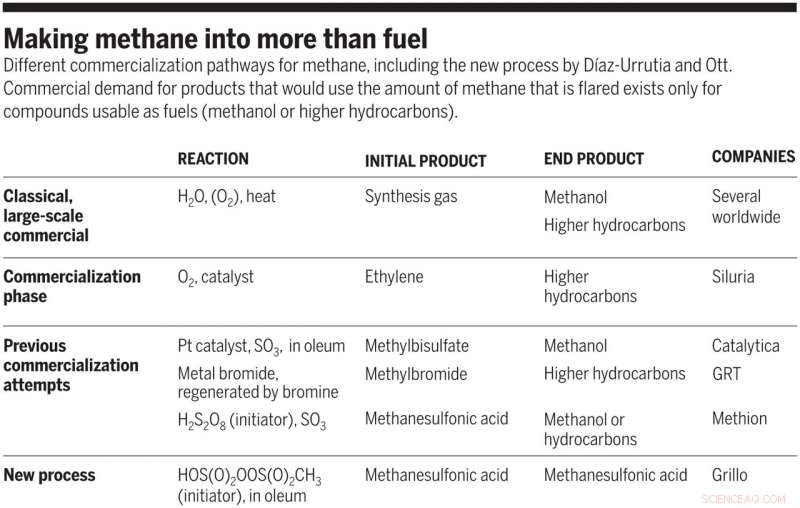
Faire du méthane plus que du carburant. Différentes voies de commercialisation du méthane, y compris le nouveau processus de Díaz-Urrutia et Ott. La demande commerciale pour des produits qui utiliseraient la quantité de méthane brûlé à la torche n'existe que pour les composés utilisables comme carburants (méthanol ou hydrocarbures supérieurs). Crédit :Sciences, doi:10.1126/science.aav0177
Dans ce contexte, le potentiel de sulfonation du méthane (CH
CH
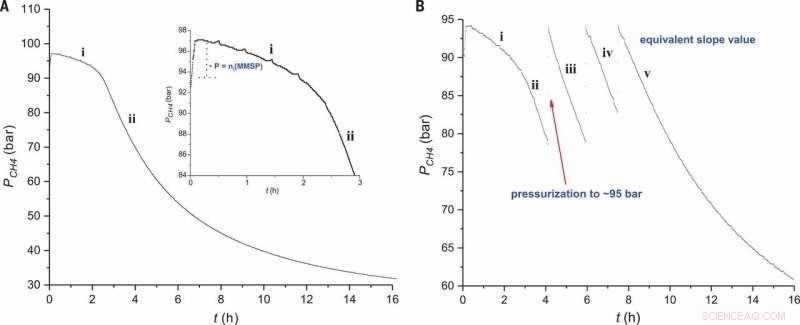
Profil de réaction pour la sulfonation du méthane. La pression de CH4 est tracée en fonction du temps dans des conditions standard (A) en utilisant un initiateur électrophile à 0,9 % en mole (Figure 2, entrée 2) et (B) ajouts successifs de CH4 (Fig 2, entrée 3). L'encart dans (A) montre une vue agrandie de la région i. Crédit :Sciences, doi:10.1126/science.aav0177.
Les scientifiques ont d'abord étudié la réaction dans un système discontinu pour optimiser les conditions expérimentales et mieux comprendre le mécanisme de réaction. Pour l'initiateur électrophile, ils ont utilisé de l'acide sulfurique de monométhylsulfonylperoxyde (MMSP) pour améliorer la faisabilité technique. Pour une productivité accrue, ils ont utilisé un réacteur de quatre litres au lieu d'un réacteur de 400 ml, en raison de plus grandes quantités de CH
Lorsque les scientifiques ont examiné le profil de réaction de l'expérience, ils ont observé une période d'induction immédiatement après l'ajout du réacteur électrophile, où la quantité de MSA (produit) était proportionnelle à la quantité initiale de MMSP (initiateur). Au stade deux du profil de réaction, ils ont observé la solubilité du CH
Sulfonation du méthane en MSA. (A) Schéma du processus Díaz-Urrutia et Ott. La réaction se déroule en cascade à travers des réacteurs connectés en série. L'usine pilote pourrait produire jusqu'à 20 tonnes de MSA par an. L'excès de SO3 est trempé dans le réacteur Q, le flux excédentaire de CH4 et le flux de puisard MSA/H2SO4 sont recyclés vers le réacteur 1, et le mélange enrichi en MSA est distillé dans la colonne D pour obtenir du MSA pur. (B) La concentration de MSA augmente lors de son passage dans les réacteurs. (C) Réacteur à fenêtre oblongue en quartz avec turbine à gaz, pour un meilleur mélange de CH4. Crédit :Sciences, doi:10.1126/science.aav0177.
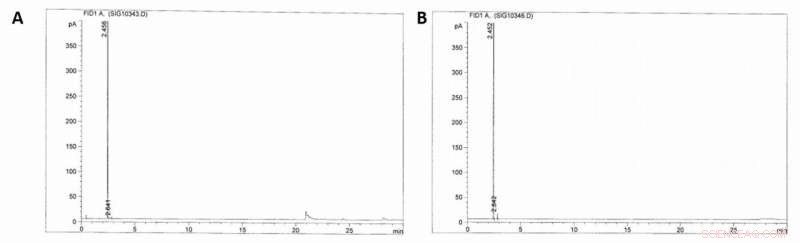
Les premiers résultats étant très prometteurs, les scientifiques ont construit une usine pilote et testé la faisabilité économique et technique de la production de MSA à l'échelle industrielle. Díaz-Urrutia et Ott ont construit l'usine avec une capacité projetée de 20 tonnes/an de production de MSA, sur la base de leurs réactions par lots à l'échelle du laboratoire, et pris en compte la solubilité et le recyclage du méthane, ainsi que pour la concentration de trioxyde de soufre et de méthane. Cette configuration a permis aux scientifiques d'augmenter constamment la concentration de MSA au fur et à mesure que le mélange réactionnel passait dans les réacteurs. Lorsqu'ils ont utilisé la chromatographie en phase gazeuse avec détection par ionisation de flamme (GC-FID) pour surveiller les échantillons, ils n'ont pas détecté la présence d'alcanes supérieurs dans le flux recyclé de méthane ou de tout autre produit de recombinaison radicalaire, permettant son utilisation directe comme stock de rétroaction pour la réaction en cascade.
Chromatogrammes GC-FID. A) Chromatogramme GC-FID de la phase gazeuse du réacteur (100 bars) avant la sulfonation du méthane. B) Chromatogramme GC-FID de la phase gazeuse après (~40 bar) la sulfonation du méthane (16 h, acide sulfurique fumant 36%, 500C). Crédit :Sciences, doi:10.1126/science.aav0177.
Pour s'offrir du MSA pur, Díaz-Urrutia et Ott ont complété le processus par une étape de distillation finale. Ils ont ensuite recyclé le mélange restant d'acide sulfurique et de MSA vers le premier réacteur pour une régénération continue du trioxyde de soufre et de l'acide sulfurique (SO
Si ce nouveau procédé d'acide méthanesulfonique rencontre du succès sur le marché, des réactifs moins chers pourront remplacer les acides minéraux actuellement utilisés. Cependant, même si la production de MSA devait augmenter de façon spectaculaire, la quantité de méthane consommée dans le processus serait encore éclipsée par les quantités torchées. Néanmoins, les travaux de Díaz-Urrutia et Ott prédisent un nouveau processus chimique synthétique pour synthétiser un produit chimique intéressant, permettant aux scientifiques d'envisager à l'avenir une gamme de produits à valeur ajoutée dérivés du méthane ou d'alcanes supérieurs en utilisant cette voie de la chimie des superacides.
© 2019 Réseau Science X