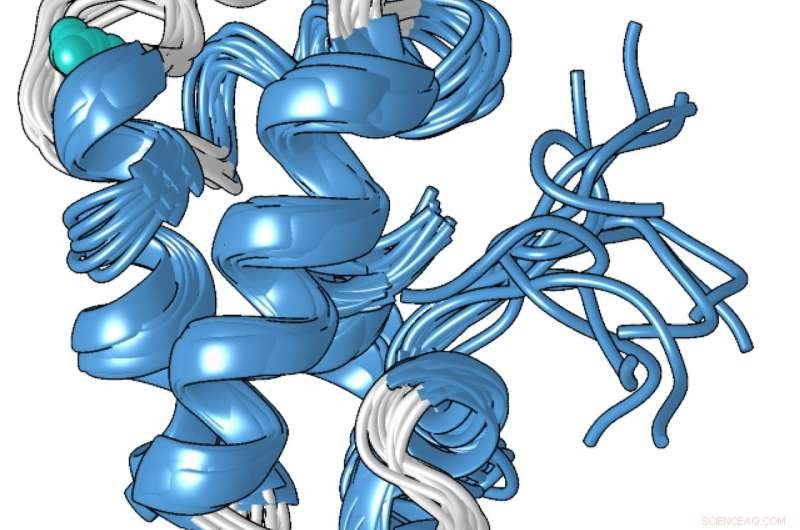
Un modèle structurel de la forme compacte liée au métal de la protéine lanmoduline, qui se lie 100 millions de fois mieux aux lanthanides - les métaux des terres rares utilisés dans les smartphones et autres technologies - qu'à d'autres métaux comme le calcium. Crédit :État de Pennsylvanie
Une protéine nouvellement découverte pourrait aider à détecter, cible, et récupérer dans l'environnement les terres rares utilisées dans les smartphones. Deux nouvelles études menées par des chercheurs de Penn State décrivent la protéine, qui est 100 millions de fois meilleur pour se lier aux lanthanides - les métaux des terres rares utilisés dans les smartphones et autres technologies - qu'à d'autres métaux comme le calcium. La première étude, qui apparaît dans le Journal de l'American Chemical Society , décrit la protéine, et le deuxième papier, qui paraît en ligne dans la revue Biochimie , décrit sa structure unique, qui joue probablement un rôle dans sa sélectivité remarquable pour les lanthanides.
"Récemment, il y a eu beaucoup d'intérêt pour l'augmentation de l'accessibilité des éléments de terres rares comme les lanthanides, qui sont utilisés dans les écrans et l'électronique des smartphones, batteries de voitures hybrides, laser, et d'autres technologies, " a déclaré Joseph Cotruvo Jr., professeur adjoint et professeur de développement de carrière Louis Martarano de chimie à Penn State et auteur des deux études. "Parce que les propriétés physiques des éléments des terres rares sont si similaires, il peut être difficile de cibler et d'en collecter un en particulier. Comprendre comment cette protéine se lie aux lanthanides avec une sélectivité incroyablement élevée pourrait révéler des moyens de détecter et de cibler ces métaux importants. »
L'équipe de recherche a découvert la protéine, qu'ils nommèrent lanmoduline, au sein de la bactérie Methylobacterium extorquens, qui pousse sur les feuilles des plantes et dans le sol et joue un rôle important dans la façon dont le carbone se déplace dans l'environnement. Les bactéries ont besoin de lanthanides pour le bon fonctionnement de certaines de leurs enzymes, dont un qui aide les bactéries à traiter le carbone, qui est nécessaire à sa croissance.
"Ces bactéries ont besoin de lanthanides et d'autres métaux comme le calcium pour se développer, " a déclaré Cotruvo. "Ils ont besoin d'un moyen d'obtenir chaque métal de l'environnement et de s'assurer que chacun va au bon endroit dans la cellule. Il semble que ces bactéries aient développé un moyen unique de cibler les lanthanides dans l'environnement, où ils sont beaucoup moins abondants que d'autres métaux comme le calcium."
La structure unique de la protéine, que Cotruvo a déterminé en collaboration avec le laboratoire de Scott Showalter, professeur agrégé de chimie à Penn State, peut expliquer pourquoi il est 100 millions de fois meilleur pour lier les lanthanides que le calcium. En l'absence de métal, Cotruvo a expliqué, la protéine est en grande partie non structurée, mais quand le métal est présent, il change de conformation en un compact, structure bien définie.
La nouvelle forme compacte contient quatre structures appelées « mains EF ». Les cellules humaines contiennent de nombreuses protéines avec les mains EF, qui sont impliqués dans l'utilisation du calcium pour des fonctions telles que l'activation des neurones et la contraction des muscles. Ces protéines se lient également aux lanthanides, bien que les lanthanides ne soient pas physiologiquement pertinents chez l'homme et que les protéines ne soient que 10 ou 100 fois plus susceptibles de se lier aux lanthanides qu'elles ne le sont à se lier au calcium. La structure compacte de la protéine lanmoduline contient également un acide aminé appelé proline dans une position unique dans chacune des mains EF, ce qui peut contribuer à la sélectivité des lanthanides de la protéine.
"Le mécanisme de la sélectivité de la lanmoduline pour les lanthanides n'est pas encore clair, mais nous pensons que cela se résume au changement structurel qui se produit en présence de métaux, " a déclaré Cotruvo. "Ce changement structurel est important pour la fonction de la protéine; par exemple, certaines interactions protéine-protéine peuvent se produire uniquement lorsque la protéine est sous sa forme compacte. Une très petite quantité de lanthanides est nécessaire pour induire le changement de conformation, mais il faudrait beaucoup plus de calcium, plus que les bactéries peuvent avoir, induire réellement le changement. Cela aiderait à assurer la sélectivité pour les lanthanides à l'intérieur des cellules. »
Comprendre comment la protéine est si sélective peut fournir des informations pour la collecte de lanthanides à des fins industrielles, y compris l'extraction des flux de déchets miniers.
« Traiter ces flux pour séparer les éléments des terres rares des autres métaux de manière économique est un défi, " dit Cotruvo, "à la fois en raison de la faible abondance des terres rares et de leur insolubilité, nécessitant de grandes quantités d'acide pour les maintenir en solution. L'abaissement du pH diminue généralement l'affinité envers les métaux, mais nous pensons que cette protéine commence avec une affinité si élevée qu'elle pourrait aider à surmonter ces défis. Nous investiguons présentement cette possibilité."
En plus d'explorer le mécanisme de sélectivité de la protéine et la fonction des acides aminés situés de manière unique, l'équipe de recherche explore également l'affinité de la protéine pour d'autres métaux, car les lanthanides se trouvent souvent en présence d'autres métaux, y compris le fer, manganèse, et aluminium, qui se produisent en plus grande abondance.
« Nous sommes également très intéressés par la fonction biologique de la protéine, ", a déclaré Cotruvo. "Mais en fin de compte, nous espérons que la compréhension de la protéine conduira à des moyens plus respectueux de l'environnement d'acquérir des métaux des terres rares de l'environnement."