Crédit :Angewandte Chemie
"Mines urbaines", le recyclage des métaux précieux des gadgets électroniques, devient de plus en plus important, bien que les procédés à la fois efficaces et respectueux de l'environnement soient encore rares. Une équipe internationale de scientifiques a maintenant approfondi la question de la dissolution de l'or, en particulier, comment les composés organiques contenant des thiols aident à dissoudre l'or élémentaire. Leur étude publiée dans la revue Angewandte Chemie propose sélective, vite, et des procédés pratiques de lixiviation de l'or assistée par thiol.
La méthode traditionnelle de recyclage des « déchets » d'or est en train de fondre :l'or dentaire et les bijoux peuvent être recyclés à près de 100 %. Recyclage des métaux précieux dans les smartphones, des ordinateurs, et d'autres gadgets électroniques est beaucoup plus difficile, et la citation de récupération est encore faible. Malgré leur abondance dans les appareils électroniques, leur contenu relatif est encore trop faible pour permettre une exploitation urbaine réellement économique.
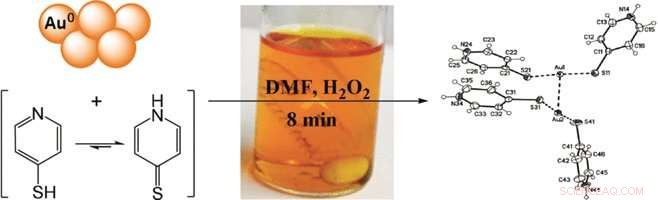
La méthode traditionnelle d'extraction de l'or est la lixiviation hydrométallurgique au cyanure, qui produit une grande quantité de déchets dangereux tout en étant relativement peu sélectif. Des concepts plus récents reposent sur la complexation de l'or dans des solutions organiques car il forme des complexes solubles avec des réactifs soufrés. Cependant, les procédés doivent être réalisables à grande échelle tout en évitant les composés toxiques ou dangereux. Maintenant, Timo Repo à l'Université d'Helsinki, Finlande, et ses collègues ont approfondi les détails de l'extraction sélective de l'or en solution organique. Ils proposent une méthode efficace de récupération d'or à partir de déchets électroniques avec des pyridinethiols et du peroxyde d'hydrogène comme réactifs, le diméthylformamide chimique comme solvant organique, et, en option, soufre élémentaire pour réduire la charge de réactif.
Le pyridinethiol est la pyridine, un cycle aromatique azoté, avec un groupe thiol, SH, ajouté à son anneau. Le réactif ne lie pas seulement l'or élémentaire pour former des complexes solubles, mais le complexe a aussi une structure linéaire favorable formée par deux molécules de pyridinethiol de part et d'autre de l'atome d'or. Lors de l'oxydation, il se transforme en un produit contenant de l'or cationique stable en solution organique. Cette formation complexe à deux ligands est une spécialité de l'or, favorisant l'énergétique de dissolution et d'oxydation. Par conséquent, les auteurs ont rapporté une dissolution presque quantitative de l'or à partir de la poudre, film, ou des cartes électroniques après 20 minutes de temps d'extraction.
Mais comment distinguer la dissolution de l'or de celle des autres métaux précieux ? Contrairement à l'or ayant une oxydation à un électron, le platine et le palladium nécessitent des oxydations à deux électrons et ne sont donc pas accessibles avec cette méthode. En revanche, le cuivre et l'argent forment des complexes avec les pyridinethiols, mais pas aussi efficace que l'or. Par conséquent, avant de dissoudre l'or de la région du "doigt d'or" dans une carte de circuit imprimé, les scientifiques ont d'abord extrait le cuivre et l'argent avec des solutions contenant de l'ammoniac et du sulfate, qui sont des méthodes établies.
En examinant le mécanisme exact de la dissolution de l'or assistée par thiol, les scientifiques ont découvert une variété étonnamment élevée de produits secondaires contenant du soufre. Certains d'entre eux semblaient être cruciaux pour procéder à la réaction d'oxydation, pour des exemples