Une représentation d'artiste d'un biofilm abritant des bactéries sphériques et en forme de bâtonnets résistantes aux antibiotiques. Crédit :Kateryna Kon/Shutterstock.com
Les surfaces avec lesquelles les gens interagissent au quotidien peuvent sembler plutôt banales, mais à l'échelle moléculaire, il y a plus d'activité qu'il n'y paraît.
Chaque surface que nous touchons a ses propres propriétés chimiques uniques. C'est à cause de ces propriétés que certains matériaux adhèrent aux surfaces, tandis que d'autres glissent. Pour une personne, une surface collante peut être une gêne mineure, mais pour une cellule bactérienne, l'attachement à la surface peut être une question de vie ou de mort. Les bactéries ont développé leurs propres surfaces pour être collantes, comme le Velcro.
Lorsque des bactéries colonisent une surface, ils créent une communauté appelée biofilm, qui peut être une source d'infection sur les dispositifs médicaux ou les implants. Les inquiétudes croissantes concernant ces infections ont conduit un certain nombre de chercheurs à développer des matériaux pour bloquer ces films parfois dangereux.
En tant que chimistes biophysiques, mon groupe de recherche et moi essayons de comprendre les forces moléculaires qui permettent aux molécules biologiques – comme celles des bactéries – de se fixer aux surfaces au cours des premières phases de formation du biofilm. En comprenant cette première étape d'attachement, nous pouvons réduire les risques qu'un biofilm se forme sur les dispositifs médicaux implantés et constitue une menace pour l'homme.
Colonies bactériennes
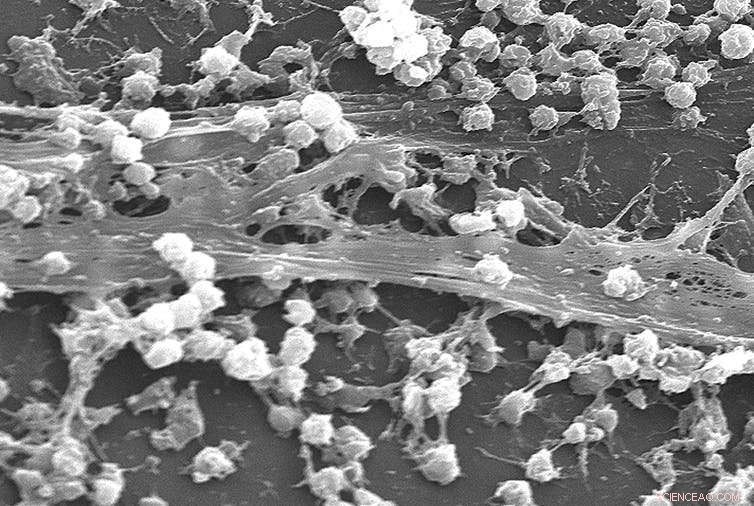
Biofilm de Staphylococcus aureus à la surface d'un cathéter. Crédit :Rodney M. Donlan, Janice Carr /CDC
Les biofilms sont des communautés denses de bactéries ou d'autres micro-organismes vivant sur une surface. Comme une ville, la croissance au sein d'un biofilm présente certains avantages. Par exemple, il fournit un support structurel, comme les planchers d'un gratte-ciel, et les microbes peuvent partager des nutriments. Par rapport aux bactéries flottantes, les bactéries dans un biofilm sont protégées, leur permettant d'échapper à notre système immunitaire et de résister aux antibiotiques.
Lorsque des biofilms se forment sur des dispositifs médicaux ou des implants, ils peuvent servir de source persistante d'infections difficiles à traiter. Ceux-ci coûtent non seulement des milliards de dollars à traiter, mais font des milliers de morts chaque année aux États-Unis seulement.
Les scientifiques tentent de comprendre comment se forment les biofilms et comment les prévenir. Les biologistes moléculaires étudient comment l'ADN bactérien code pour la machinerie qui permet aux cellules de se fixer aux surfaces et les unes aux autres. Les microbiologistes et les chimistes médicinaux recherchent des médicaments capables de pénétrer et de perturber les biofilms. Et des chimistes biophysiques comme moi essaient de déceler les interactions moléculaires qui rendent ces biofilms difficiles à prévenir.
Complexité de surface
Staphylococcus aureus et S. epidermidis sont deux espèces bactériennes qui posent normalement peu de problèmes à notre organisme. Cependant, lorsqu'un biofilm staphylococcique se forme à la surface d'un implant médical comme une hanche artificielle, ces cellules peuvent provoquer des maladies. Les biofilms staphylococciques sont liés par des sucres ou des polysaccharides, protéines et acides nucléiques, les éléments constitutifs moléculaires de tous les organismes vivants. Ces composants permettent aux cellules bactériennes de se coller non seulement les unes aux autres, mais aussi aux surfaces naturelles et implantées dans le corps - comme une valve cardiaque.
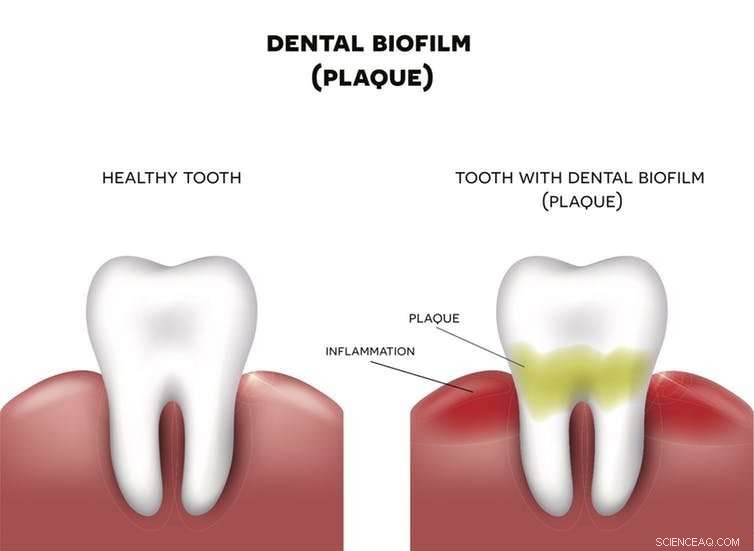
Les biofilms imprègnent tous les éléments de notre vie. Par exemple, la plaque qui se forme sur vos dents est un biofilm qui abrite les bactéries. Si la plaque n'est pas enlevée, le tissu autour de la dent deviendra enflammé. Crédit :Nita_Nita/Shutterstock.com
Les surfaces des dispositifs médicaux sont complexes, surtout une fois qu'ils ont été exposés au corps. Les protéines du sang humain recouvrent rapidement la surface des implants médicaux, modifier le caractère à mesure que le patient et l'appareil vieillissent. Lorsqu'une cellule bactérienne s'attache à l'une de ces surfaces, les composants de la cellule interagissent avec la surface de l'implant médical, formant un réseau complexe d'interactions. Dans notre recherche, nous étudions les protéines de surface bactériennes impliquées dans l'attachement à la surface.
L'étude de ces interactions est un défi. Typiquement, les expériences de chimie sont réalisées en solution, mais les expériences de biofilm doivent être faites sur une surface. Détecter les molécules à la surface est un défi. C'est parce qu'il y a moins de ces molécules par rapport au volume global du matériau, tout comme la peau de la tomate est une infime fraction de la masse de la tomate entière.
Présentation de l'échelle nanométrique
Pour surmonter cette limite, nous étudions comment les protéines présentes sur la surface bactérienne interagissent avec les surfaces des nanoparticules. Spécifiquement, nous utilisons des nanoparticules conçues pour imiter la surface des dispositifs médicaux, et nous ciblons des protéines impliquées dans les infections à staphylocoques, une source majeure de maladies liées à l'hôpital.
Les nanoparticules ont un diamètre beaucoup plus petit qu'une cellule bactérienne. Mais alors qu'une cellule typique éclipserait une nanoparticule, la nanoparticule est encore beaucoup plus grosse que les molécules à la surface d'une cellule. En utilisant de nombreuses nanoparticules, il est plus facile d'observer comment la bactérie et la particule interagissent et d'observer les molécules bactériennes impliquées dans la formation du biofilm.

Randika Perera place un échantillon de nanoparticules dans un spectromètre RMN, l'un des instruments utilisés pour étudier les interactions protéine-surface. Crédit :Sarah Tewolde, Bureau des affaires publiques de la MSU, CC BY-SA
Spécifiquement, nous essayons de comprendre la structure et l'orientation des protéines sur différents types de surfaces. Bien que nous ne soyons pas le premier ou le seul groupe à s'intéresser à ce sujet, nos travaux ont commencé à révéler les détails moléculaires de la façon dont les protéines interagissent avec les surfaces des nanoparticules.
Nous pouvons sonder à quel point les bactéries s'accrochent à une surface - et nous pouvons examiner comment les molécules de protéines rivalisent pour la même surface. Par exemple, étant donné une collection de protéines bactériennes, lequel de ces éléments finira par s'attacher à la surface d'un implant médical ?
Au fur et à mesure que nous découvrirons les réponses à ces questions, nous pourrons identifier les éléments importants impliqués dans la formation précoce du biofilm. Cela sera utile pour les scientifiques qui tentent d'inhiber ces interactions thérapeutiquement, ou ceux qui cherchent à concevoir de nouvelles surfaces résistantes aux biofilms.
Cet article est republié à partir de The Conversation sous une licence Creative Commons. Lire l'article original. 