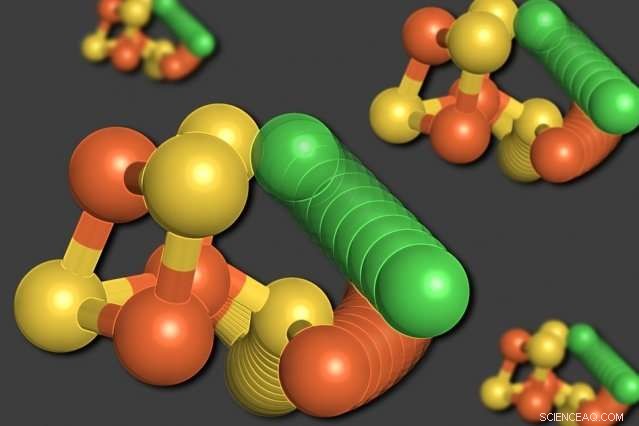
Des chercheurs du MIT ont montré que certains des atomes d'une enzyme appelée monoxyde de carbone déshydrogénase peuvent se réorganiser lorsque les niveaux d'oxygène sont faibles. Un atome de nickel (vert) quitte la structure en forme de cube, déplaçant un atome de fer (orange). Un atome de soufre (jaune) sort également du cube. Crédit :Elizabeth Wittenborn
De nombreux microbes ont une enzyme qui peut convertir le dioxyde de carbone en monoxyde de carbone. Cette réaction est critique pour la construction de composés carbonés et la production d'énergie, en particulier pour les bactéries qui vivent dans des environnements sans oxygène.
Cette enzyme présente également un grand intérêt pour les chercheurs qui souhaitent trouver de nouvelles façons d'éliminer les gaz à effet de serre de l'atmosphère et de les transformer en composés carbonés utiles. Les procédés industriels actuels de transformation du dioxyde de carbone sont très énergivores.
« Il existe des procédés industriels qui font ces réactions à hautes températures et hautes pressions, et puis il y a cette enzyme qui peut faire la même chose à température ambiante, " dit Catherine Drennan, professeur de chimie et de biologie au MIT et chercheur au Howard Hughes Medical Institute. "Pendant longtemps, les gens se sont intéressés à comprendre comment la nature effectue cette chimie difficile avec cet assemblage de métaux. »
Drennan et ses collègues du MIT, Université Brandeis, et l'Université d'Aix-Marseille en France ont maintenant découvert un aspect unique de la structure du "C-cluster", la collection d'atomes de métal et de soufre qui forme le cœur de l'enzyme monoxyde de carbone déshydrogénase (CODH). Au lieu de former un échafaudage rigide, comme on s'y attendait, le cluster peut en fait changer sa configuration.
"Ce n'était pas ce que nous nous attendions à voir, " dit Elizabeth Wittenborn, un récent doctorat du MIT. destinataire et auteur principal de l'étude, qui paraît dans le numéro du 2 octobre de la revue eLife .
Une roue moléculaire
Les clusters contenant des métaux tels que le cluster C effectuent de nombreuses autres réactions critiques chez les microbes, y compris le fractionnement de l'azote gazeux, difficiles à reproduire industriellement.
Drennan a commencé à étudier la structure de la monoxyde de carbone déshydrogénase et du cluster C il y a environ 20 ans, peu de temps après avoir commencé son laboratoire au MIT. Elle et un autre groupe de recherche ont chacun proposé une structure pour l'enzyme en utilisant la cristallographie aux rayons X, mais les structures n'étaient pas tout à fait les mêmes. Les différences ont finalement été résolues et la structure du CODH était considérée comme bien établie.
Wittenborn a repris le projet il y a quelques années, dans l'espoir de comprendre pourquoi l'enzyme est si sensible à l'inactivation par l'oxygène et de déterminer comment le cluster C se forme.
A la surprise des chercheurs, leur analyse a révélé deux structures distinctes pour le cluster C. Le premier était un arrangement qu'ils s'attendaient à voir :un cube composé de quatre atomes de soufre, trois atomes de fer, et un atome de nickel, avec un quatrième atome de fer connecté au cube.
Dans la seconde structure, cependant, l'atome de nickel est retiré de la structure en forme de cube et prend la place du quatrième atome de fer. L'atome de fer déplacé se lie à un acide aminé voisin, cystéine, qui le maintient dans son nouvel emplacement. L'un des atomes de soufre sort également du cube. Tous ces mouvements semblent se produire à l'unisson, dans un mouvement que les chercheurs décrivent comme une "roue moléculaire".
"Le soufre, le fer, et le nickel déménage tous dans de nouveaux endroits, " dit Drennan. "Nous avons été vraiment choqués. Nous pensions avoir compris cette enzyme, mais nous avons découvert qu'il faisait ce mouvement incroyablement dramatique que nous n'avions jamais prévu. Ensuite, nous avons trouvé plus de preuves qu'il s'agit en fait de quelque chose de pertinent et d'important - ce n'est pas seulement un coup de chance, mais une partie de la conception de ce cluster. »
Les chercheurs pensent que ce mouvement, qui se produit lors de l'exposition à l'oxygène, aide à protéger le cluster de se désintégrer complètement et de manière irréversible en réponse à l'oxygène.
"On dirait que c'est un filet de sécurité, permettant aux métaux d'être déplacés vers des endroits où ils sont plus en sécurité sur la protéine, " dit Drennan.
Douglas Rees, professeur de chimie à Caltech, a décrit l'article comme "une belle étude d'un processus de conversion de cluster fascinant."
"Ces amas ont des caractéristiques minérales et on pourrait penser qu'ils seraient" aussi stables qu'un roc, '" dit Rees, qui n'a pas participé à la recherche. "Au lieu, les clusters peuvent être dynamiques, ce qui leur confère des propriétés essentielles à leur fonction dans un cadre biologique. »
Pas un échafaudage rigide
Il s'agit du plus grand changement de métal jamais observé dans un cluster enzymatique, mais des réarrangements à plus petite échelle ont été observés dans d'autres, y compris un cluster métallique trouvé dans l'enzyme nitrogénase, qui convertit l'azote gazeux en ammoniac.
"Autrefois, les gens pensaient que ces grappes étaient vraiment ces échafaudages rigides, mais au cours des dernières années, il y a de plus en plus de preuves qu'ils ne sont pas vraiment rigides, " dit Drennan.
Les chercheurs tentent maintenant de comprendre comment les cellules assemblent ces grappes. En savoir plus sur le fonctionnement de ces clusters, comment ils sont assemblés, et comment ils sont affectés par l'oxygène pourraient aider les scientifiques qui tentent de copier leur action pour un usage industriel, dit Drennan. Il y a un grand intérêt à trouver des moyens de lutter contre l'accumulation de gaz à effet de serre en, par exemple, convertir le dioxyde de carbone en monoxyde de carbone puis en acétate, qui peut être utilisé comme bloc de construction pour de nombreux types de composés contenant du carbone utiles.
"C'est plus compliqué qu'on ne le pensait. Si on le comprend, alors nous avons une bien meilleure chance d'imiter vraiment le système biologique, " dit Drennan.
Cette histoire est republiée avec l'aimable autorisation de MIT News (web.mit.edu/newsoffice/), un site populaire qui couvre l'actualité de la recherche du MIT, innovation et enseignement.