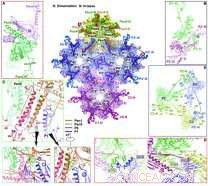
Aperçu des interactions à la surface de la capside interne. Crédit :WANG Xiangxi
L'herpèsvirus est génétiquement et structurellement l'un des virus les plus complexes. Il se propage efficacement au sein de la population hôte, provoquant une série de maladies chez l'homme, y compris les troubles congénitaux et les cancers.
La voie d'assemblage de l'herpèsvirus produit trois types distincts de capsides appelées A-, capsides B et C, respectivement. Les trois types de capsides ont tous des coquilles angulaires matures et un mécanisme d'assemblage similaire. Cependant, on sait peu de choses sur la structure et le mécanisme d'assemblage de la capside du virus de l'herpès simplex (HSV).
En utilisant une combinaison de reconstruction "à base de blocs" et de corrections précises de la sphère d'Ewald, Pr WANG Xiangxi, Prof. RAO Zihe et Prof. ZHANG Xinzheng à l'Institut de biophysique de l'Académie chinoise des sciences, avec des collègues de l'Université normale du Hunan, et les Instituts nationaux de contrôle des aliments et des drogues, reconstruit la structure 3.1 Å de la capside B du virus herpès simplex de type 2 (HSV-2) et construit le modèle atomique, élargissant ainsi la compréhension du mécanisme d'assemblage de la capside. Cette étude a été publiée dans Science .
En tant que l'une des quatre principales couches structurelles, la capside 125 nm de l'herpèsvirus protège non seulement le génome viral des dommages mécaniques et autres, mais fonctionne également pour libérer le génome viral dans le noyau de la cellule hôte pendant l'infection initiale et pour emballer le génome pendant la maturation.
Les chercheurs ont découvert qu'il existe quatre principaux conformères de la principale protéine de capside VP5, qui présente des différences frappantes dans la configuration et le mode d'assemblage pour former de vastes réseaux intermoléculaires.
Le triplex, un assemblage hétérotrimérique qui s'adapte entre les hexamères et les pentamères à des positions quasi triples pour cimenter la capside ensemble, se compose de deux exemplaires de VP23, chacun présentant des conformations remarquablement différentes, et une copie de VP19C. Six copies de la petite protéine de capside VP26 forment un anneau au sommet de l'hexon et stabilisent davantage la capside.
Basé sur la structure de la capside, les chercheurs ont proposé un modèle pour l'assemblage ordonné de la capside à l'aide d'un triplex et de son triangle lasso lié de manière covalente formé de trois VP5. Ces unités d'assemblage de base se regroupent ensuite en structures d'ordre supérieur se conformant à une double symétrie et guident les intermédiaires d'assemblage naissants dans la géométrie correcte T =16, permettant les premiers pas vers la compréhension des moteurs d'assemblage et des bases de stabilité de la capside.