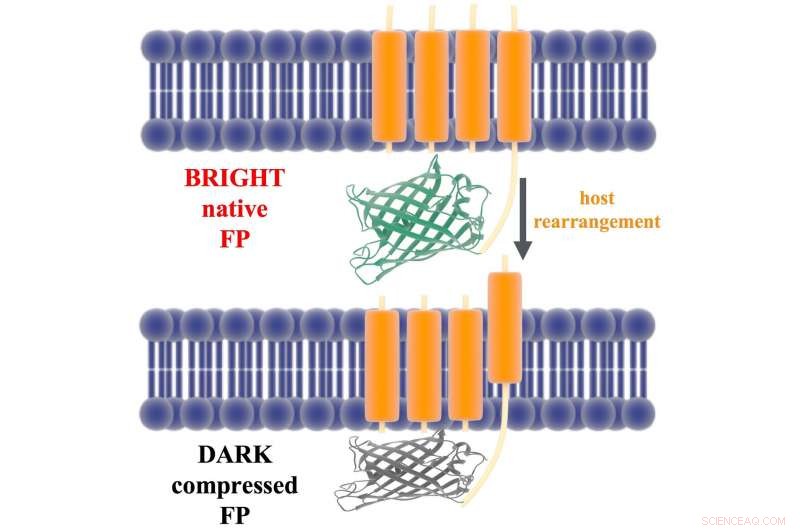
Une illustration montre l'attache qui relie le domaine fluorescent d'une protéine ArcLight (vert et gris) à son domaine de détection de tension (orange) dans la membrane d'un neurone. Les scientifiques de Rice suggèrent dans une nouvelle étude que la dépolarisation de la membrane déplace le domaine de détection de tension, qui à son tour comprime la protéine fluorescente et l'éteint. Crédit :Léna Simine
Les scientifiques de l'Université Rice ont efficacement étouffé un débat sur le mécanisme derrière un biocapteur fluorescent qui surveille les neurones en détectant les changements de tension.
Les travaux dirigés par le chimiste théoricien Rice Peter Rossky et la chercheuse postdoctorale Lena Simine ont confirmé par des simulations informatiques leur théorie selon laquelle un processus mécanique contrôle l'extinction de la fluorescence dans ArcLight, un indicateur de tension synthétique placé dans les protéines qui tapissent les membranes internes des neurones.
A travers leurs modèles, les chercheurs ont couplé à la fois le mécanisme et la fluorescence à la force des champs électriques qu'ils ont observés à travers le chromophore, la partie fluorescente de la protéine. Leurs résultats ont montré qu'une simple mesure du champ dans une simulation pourrait être utilisée pour prédire si et dans quelle mesure les nouveaux capteurs fluorescents se comporteront avant que les chercheurs ne les synthétisent, dit Rossky.
L'étude apparaît dans le Journal de l'American Chemical Society .
ArcLight, développé par le neuroscientifique de Yale Vincent Pieribone en 2012, est une protéine indicatrice de tension de fluorescence codée génétiquement. Il contient une mutation qui atténue le signal de fluorescence lorsque la tension augmente et s'éclaircit lorsque la tension chute. Cela le rend utile pour suivre les signaux dans le système nerveux en exprimant la protéine dans les neurones et en voyant comment ils s'allument.
La protéine est attachée à la paroi cellulaire du neurone par un composant de détection de tension qui se déplace de quelques angströms lorsqu'un signal provenant d'un autre neurone modifie la charge électrique dans la membrane. Les chercheurs de Rice ont émis l'hypothèse que le mouvement tire la protéine contre la membrane, en le comprimant et en étouffant la fluorescence.
Rossky a déclaré que la modification de la forme de la protéine rapproche deux résidus d'un nanomètre l'un de l'autre. C'est suffisant pour dicter comment le chromophore se débarrasse de l'énergie, soit sous forme de lumière (en abandonnant les photons et en émettant de la fluorescence) soit sous forme de chaleur.
"Nous avons émis l'hypothèse quel changement de géométrie se produit dans la protéine en raison de la réponse de la membrane, " Rossky a dit. " Et puis nous avons demandé, « Est-ce que cela change la fluorescence ? » Et nous avons constaté que c'est le cas. En outre, nous avons montré que le suivi d'une qualité beaucoup plus simple - le champ électrique le long de deux axes d'où provient la fluorescence - est suffisant pour décrire complètement la réponse. »
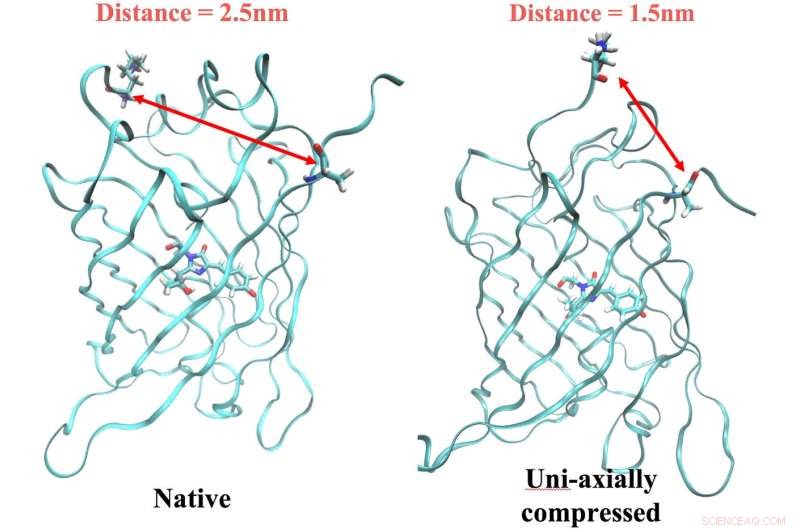
La protéine ArcLight native à gauche, avec des résidus d'ancrage distants de 2,5 nanomètres, fluorescent lorsqu'il est déclenché par la lumière à la bonne fréquence. Mais la fluorescence s'arrête lorsque la protéine est compressée, ce qui rapproche les ancres d'un nanomètre. Les chercheurs de Rice ont découvert un lien entre le mécanisme et un signal électrique dans la protéine qui peut être utilisé comme marqueur lors de la simulation de nouvelles protéines fluorescentes avec des modèles informatiques. Crédit :Léna Simine
ArcLight s'est avéré être un bon modèle. Piéribone, un collaborateur Rice, a déclaré aux participants lors d'une conférence à Rice en 2014 que même lui ne savait pas exactement comment cela fonctionnait. La conférence a inspiré Simine, qui venait d'arriver à Rice, entreprendre une étude du mécanisme.
"Je pensais, 'Cela semble être un bon projet pour moi, '" elle a dit.
Travailler avec des chercheurs du groupe de José Onuchic du Rice's Center for Theoretical Biological Physics (CTBP) a permis à Simine, un physicien chimiste de formation, profiter de l'expertise du centre dans la simulation de protéines à tester.
Elle a déclaré qu'un débat d'une décennie entre scientifiques n'a pas permis de déterminer si les propriétés mécaniques ou électriques des protéines provoquaient leur fluorescence. Il s'est avéré que c'était un peu des deux.
"Un article récent a donné des preuves informatiques qu'il était principalement électrostatique, et c'est assez logique parce que la protéine est très molle, " dit Simine. " Nous avons aussi pensé que ces mutations collent à la membrane, et quand ils le font, l'orientation de la protéine permet à la protéine d'être compressée. mais a également laissé une trace électrique dans la protéine qui a pu être observée dans la simulation.
"Nous y avons réfléchi et avons trouvé une coordonnée de réaction, " dit-elle. " Nous pouvons prendre n'importe quelle mutation de la séquence de cette protéine et la traduire en deux nombres qui sont les entrées de ce modèle, les champs électrostatiques autour du chromophore. C'est un bon, théorie phénoménologique élégante."
Le laboratoire prévoit de tester sa technique sur des protéines fluorescentes synthétisées sur mesure et des simulations correspondantes pour voir si leur théorie et leur expérimentation continuent de s'aligner. S'ils le font, ils s'attendent à ce que leurs modèles soient très utiles aux biologistes synthétiques créant de nouvelles classes de marqueurs fluorescents.
"Si vous voulez connaître la fluorescence d'une molécule donnée, tu fais l'expérience, " dit Rossky. " Mais si tu veux savoir pourquoi ça marche, ces calculs sont incroyablement précieux."