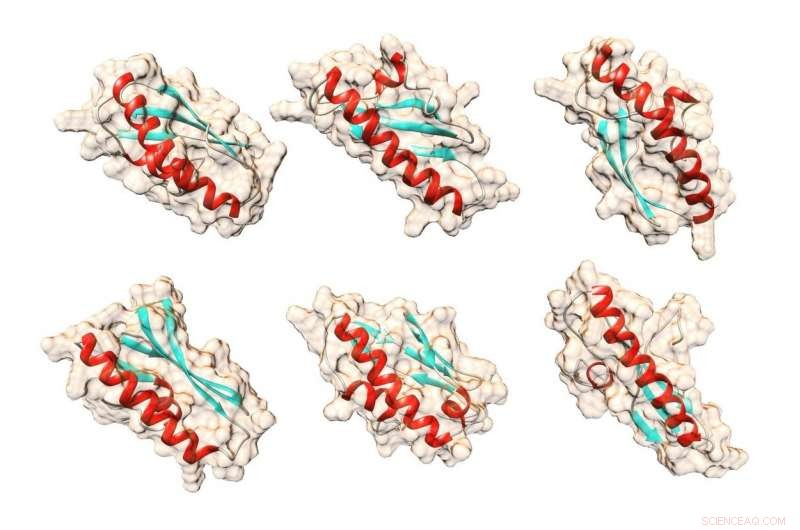
Formes possibles pour la protéine de levure Bsc4 que l'algorithme informatique QUARK a prédit en utilisant uniquement les séquences d'acides aminés de la protéine. Crédit :Matthieu Cordes, en utilisant le package graphique moléculaire UCSF Chimera
Une protéine de levure qui a évolué à partir de zéro peut se replier en une forme tridimensionnelle, contrairement à la compréhension générale des jeunes protéines, selon une nouvelle recherche menée par l'Université de l'Arizona.
Les scientifiques pensaient que ces protéines nouvellement évoluées étaient des travaux en cours qui ne pouvaient pas se plier en des formes complexes comme le font les protéines plus anciennes.
"Cette nouvelle étude de notre laboratoire fournit la toute première preuve qu'une protéine récemment développée à partir de zéro peut en fait se replier en une forme tridimensionnelle compacte, " a déclaré l'auteur principal Matthew Cordes, professeur agrégé de chimie et de biochimie à l'UA.
"Ce que nous avons découvert n'apparaît pas comme une molécule biologique complètement développée. Cela ressemble à ce à quoi on pourrait penser qu'une protéine nouveau-née ressemblerait - peut-être un peu maladroite ou vaguement formée, " dit Cordes, membre de l'Institut BIO5 de l'UA. "Mais néanmoins, cette protéine se replie en une structure tridimensionnelle et à bien des égards, elle ressemble à des protéines qui ont évolué il y a longtemps.
"C'est étonnant quand je le regarde. J'ai vraiment l'impression de voir quelque chose éclore."
Des preuves récentes suggèrent que de nouveaux gènes peuvent provenir des sections non codantes, ou "poubelle, " L'ADN et que ces nouveaux gènes pourraient coder pour de toutes nouvelles protéines. Les gènes codent pour des protéines, les molécules qui fonctionnent à l'intérieur des cellules.
La co-auteure Joanna Masel a déclaré :"Tous les gènes ne sont pas anciens et ceux qui ne le sont pas ne sont pas beaucoup étudiés."
Cordes est la première personne à examiner la structure de la protéine qui résulte d'un gène récemment né de l'ADN indésirable, dit Masel, professeur d'écologie et de biologie évolutive à l'UA et membre de l'Institut BIO5.
Parce que changer un gène existant semblait plus facile que d'en inventer un entièrement nouveau, les scientifiques pensaient que de nouveaux gènes survenaient en modifiant les duplicatas de gènes existants.
"L'histoire est que l'évolution n'est pas seulement un bricoleur qui retravaille ce qu'il a - parfois l'évolution invente une toute nouvelle fonctionnalité, molécule structurée, " dit Cordes.
Le document de recherche de l'équipe, "Pliabilité d'une protéine naturelle évoluée De Novo, " est en ligne dans le journal Structure et dont la publication est prévue en novembre. Les co-auteurs de Cordes et Masel sont Dixie Bungard, Jacob Coppel, Jimmy Chhun, Vlad Kumirov et Scott Foy de l'UA et Jing Yan et Vicki Wysocki de l'Ohio State University à Columbus.
Les National Institutes of Health accordent GM104040, GM113658, ES06694, CA023074 et 1S10 RR028868-01 et une subvention de la John Templeton Foundation ont financé la recherche.
Les scientifiques savent depuis plus d'une décennie que certains gènes semblent émerger tout neufs, ou de novo, de l'ADN indésirable.
Cependant, on sait peu de choses sur les protéines pour lesquelles ces gènes codent, dit Cordes, qui étudie l'évolution de la structure et de la fonction des protéines.

Matthieu H. J. Cordes, professeur agrégé de chimie et de biochimie à l'Université de l'Arizona, étudie l'évolution de la structure et de la fonction des protéines. Crédit :Beatriz Verdugo, Nouvelles de l'UA
"Mon objectif est de voir à quoi ressemblent ces protéines, " il a dit.
Cordes et ses collègues ont étudié une protéine qu'une souche de laboratoire de levure de boulanger fabrique à l'aide d'un gène de novo. Le gène BSC4 et sa protéine résultante Bsc4 semblent aider à la réparation de l'ADN.
La première étape dans l'étude d'une protéine est d'en faire beaucoup. L'équipe de Cordes a utilisé une méthode standard :ils ont inséré le gène BSC4 dans des bactéries E. coli et ont fait en sorte que les bactéries servent d'usine de fabrication de protéines. Certaines sociétés pharmaceutiques utilisent la même méthode pour fabriquer de l'insuline pour les personnes atteintes de diabète.
L'étape suivante consiste à purifier la protéine, ce qui pour Bsc4 n'avait jamais été fait auparavant, dit Cordes.
"Il y a eu un réel manque de personnes purifiant les produits de ces gènes de novo et les examinant. C'est le vide que nous essayons de combler, " il a dit.
Ordinairement, les chercheurs cristallisent ensuite la protéine et font une description détaillée de la structure de la protéine à l'aide de techniques d'imagerie à haute résolution.
Cependant, la protéine de bébé n'était pas facile à travailler, dit Cordes. L'équipe n'a pas pu le cristalliser.
L'équipe a déterminé des informations générales sur la forme et la structure de la protéine. Le gène BSC4 code pour une petite chaîne d'acides aminés, ou chaîne polypeptidique.
Dans la protéine résultante, Bsc4, plusieurs de ces chaînes se rejoignent. La protéine peut exister sous forme de deux ou trois chaînes, mais aussi en tant que groupes de nombreuses chaînes. Avoir une telle variété de tailles n'est pas typique, dit Cordes.
"La plupart des protéines naturelles existent dans une certaine taille, " dit-il. " Celui-ci peut être en groupes de quatre, cinq, six, sept - c'est une des raisons pour lesquelles vous pourriez appeler la structure floue ou rudimentaire."
La protéine présente d'autres caractéristiques des protéines normales, y compris le pliage dans des formes standard telles que des hélices alpha et des feuilles plissées bêta. En outre, la protéine va se déployer, ou dénaturer, sous certaines conditions et peut ensuite être ramené dans son état replié. La partie blanche ferme d'un œuf cuit est une protéine de blanc d'œuf dénaturée.
"Pendant de nombreuses années, les gens pensaient que les protéines devaient avoir ces structures élégantes de type origami pour fonctionner, mais il est devenu clair qu'elles peuvent avoir des troubles, ils peuvent avoir des propriétés fondues et encore faire des choses dans un organisme, " il a dit.
Cordes a qualifié Bsc4 de "globulaire" et a déclaré que la plupart des protéines globulaires naturelles n'avaient qu'une seule forme standard. Il appelle la protéine "globulaire fondue" car elle peut changer de forme.
"On pense que la protéine est impliquée dans la réparation de l'ADN et pourrait être impliquée dans la liaison de l'ADN. Il se peut que sa structure actuelle soit parfaitement adaptée à ce qu'elle doit faire, " il a dit.
"Ne pas avoir émergé comme cette œuvre d'art glorieuse rend plus crédible que ces gènes codant pour des protéines surgissent de la région génétique entre les gènes, " a dit Cordes. " Je veux savoir d'où viennent les choses dans la vie - comment la vie crée la nouveauté, comment l'évolution crée la nouveauté."