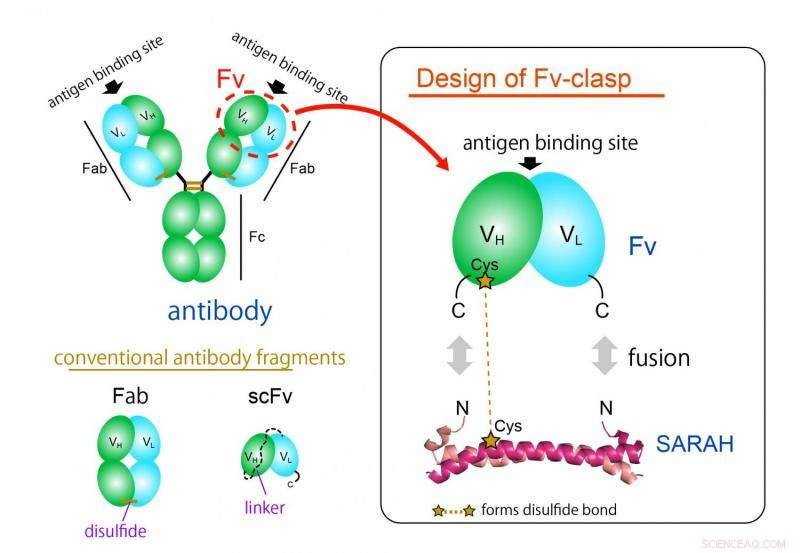
Figure 1. Concept de conception d'un nouveau format de fragment d'anticorps « Fv-clasp ». Fv-clasp est une simple fusion du domaine SARAH dérivé de la protéine Mst1 humaine au Fv (vert :chaîne lourde, cyan :chaîne légère) fragment d'un anticorps. Le dimère VH/VL est stabilisé par la conformation dimère du domaine SARAH (magenta foncé et magenta clair). Crédit :Université d'Osaka
Les anticorps sont un système d'armes puissant pour défendre notre corps contre les envahisseurs tels que les bactéries et les virus. Chaque anticorps se compose de quatre chaînes polypeptidiques d'acides aminés :deux chaînes lourdes et deux chaînes légères reliées pour former une molécule en forme de Y. Les anticorps reconnaissent un antigène spécifique unique à sa cible car ils possèdent les sites de liaison à l'antigène situés aux extrémités supérieures du Y. Bien que les thérapies à base d'anticorps aient été établies comme médicaments de première ligne, peu de progrès ont été réalisés dans l'utilisation des anticorps comme outils de recherche dans la découverte de médicaments à petites molécules, notamment dans le domaine de la cristallographie aux rayons X.
La cristallographie aux rayons X est une technique qui utilise des diagrammes de diffraction des rayons X pour déterminer la haute résolution, structures tridimensionnelles de molécules telles que les protéines, petites molécules organiques, et matériaux. Le défi majeur des approches de cristallographie aux rayons X reste la production de cristaux diffractants de haute qualité.
Dans les années récentes, il y a une utilisation croissante de fragments d'anticorps comme chaperons de cristallisation pour aider à la détermination structurelle de protéines cibles autrement "non cristallisables" ou "non médicamenteuses". La base de la stratégie est d'augmenter la probabilité d'obtenir des cristaux bien ordonnés en minimisant l'hétérogénéité conformationnelle dans la protéine cible.
Le format de fragment d'anticorps le plus couramment utilisé est le format Fab, mais il est difficile à produire dans des systèmes d'expression bactériens en raison de sa structure large et complexe. Le fragment Fv de l'anticorps, qui ne contient qu'une chaîne lourde et une chaîne légère, serait idéal pour cette application grâce à son architecture simple et petite. Cependant, Fv est rarement utilisé car les deux chaînes se dissocient facilement, entraînant une perte de fonction.

Figure 2. Structure cristalline du fermoir Fv. Structure tridimensionnelle réelle du fermoir Fv déterminée par analyse cristallographique aux rayons X. Crédit :Université d'Osaka
Maintenant, une équipe de chercheurs de l'Université d'Osaka a conçu un nouveau fragment Fv à chaîne unique avec une compatibilité de production améliorée, stabilité et cristallisabilité, tout en maintenant la capacité de liaison de la molécule d'origine. Ils ont récemment publié leurs découvertes dans Structure.
"Nous avons réussi à produire un nouveau fragment en fusionnant une structure spiralée anti-parallèle dérivée d'un domaine particulier d'une enzyme humaine, Mst1 kinase, aux sites de liaison à l'antigène d'un anticorps, ", explique l'auteur principal de l'étude, Takao Arimori. "La molécule chimérique résultante, Fermoir Fv, était fonctionnellement et structurellement équivalent au Fv de l'anticorps d'origine."
Notamment, le passage du format Fab au format Fv-clasp a nettement amélioré la cristallisation assistée par anticorps de deux protéines biologiquement importantes, les domaines extracellulaires intégrine a6b1 et sorLasorLA. L'intégrine a6b1 joue un rôle important dans la fixation des cellules iPS et des cellules ES ainsi que de nombreuses cellules cancéreuses du foie à la membrane basale, une fondation de réseau de protéines extracellulaires présente dans les tissus de la plupart des cellules et organes, tandis que sorLA est un récepteur protéique impliqué dans la maladie d'Alzheimer.
"L'applicabilité universelle de la conception du fermoir Fv à une production à grande échelle et peu coûteuse le rend souhaitable pour les applications industrielles. De plus, sa stabilité thermique élevée est un grand avantage pour les immunothérapies, " auteur correspondant Junichi Takagi dit. " En dehors du domaine de la biologie structurale, nous prévoyons que la conception du fermoir Fv contribuera à l'expansion de l'utilisation déjà éminente des anticorps dans les sciences fondamentales et appliquées. »