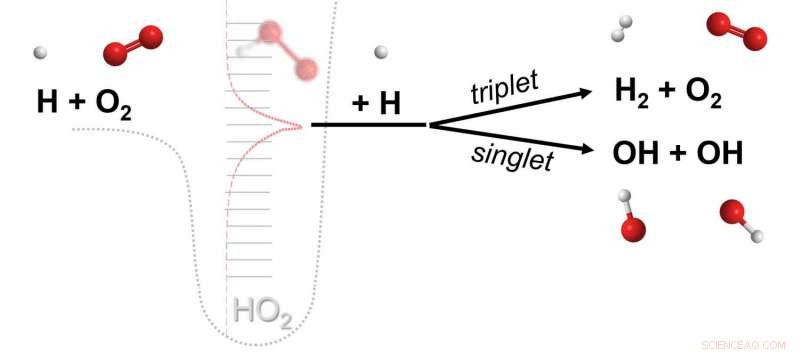
Une réaction chimique où trois molécules différentes (par exemple H, O2, H) chacun participe à la rupture et à la formation de liaisons chimiques. La réaction est médiée par un complexe de collision éphémère (HO2**) formé à partir de la collision de deux molécules (H, O2) qui réagit alors en entrant en collision avec une troisième molécule (H). Les données de calculs avancés révèlent que les réactions de cette classe, émis l'hypothèse il y a près d'un siècle, puis supposée plus tard sans importance, sont des voies chimiques majeures. Crédit :Michael P. Burke/Columbia Engineering
Une nouvelle étude dirigée par Michael P. Burke, professeur adjoint de génie mécanique à Columbia Engineering, a identifié l'importance d'une nouvelle classe de réactions chimiques impliquant trois molécules qui participent chacune à la rupture et à la formation de liaisons chimiques. La réaction de trois molécules différentes est rendue possible par un « complexe de collision éphémère, " formé de la collision de deux molécules, qui vit assez longtemps pour entrer en collision avec une troisième molécule.
Cette quatrième classe, que les chercheurs ont nommé "réactions chimiquement termoléculaires, " a été émise pour la première fois par Cyril Hinshelwood et Nikolay Semenov dans leurs études sur les réactions en chaîne dans les années 1920 et 1930 (ils ont remporté le prix Nobel de chimie en 1956 pour ce travail). Pendant des décennies, les chercheurs ont considéré ces réactions sans importance - si elles se sont même produites - et jusqu'à présent, personne ne les a étudiés. Burke, qui explore une variété de problèmes à l'interface entre la chimie physique fondamentale et les dispositifs d'ingénierie pratiques, a décidé d'étudier ces réactions après s'être rendu compte que les situations de combustion courantes, tels que ceux rencontrés dans de nombreux moteurs, ont des fractions suffisamment élevées de molécules hautement réactives connues sous le nom de radicaux libres pour rendre ces réactions possibles. La nouvelle étude est publiée aujourd'hui dans Chimie de la nature .
"La combustion a toujours été un point de départ pour comprendre toutes sortes d'autres mécanismes chimiques, " dit Burke, qui est également membre du Data Science Institute. « Il pourrait y avoir d'innombrables réactions de cette nouvelle classe qui ont un impact sur la façon dont nous modélisons la chimie en phase gazeuse, de la conception de nouveaux types de moteurs à la compréhension de la chimie planétaire responsable de la formation des nuages, changement climatique, évolution des polluants, voire peut-être la séquence de réactions qui pourraient avoir un impact sur les conditions de la vie extraterrestre. Notre découverte ouvre un tout nouveau monde de possibilités."
Par exemple, les véhicules spatiaux subissent des températures très élevées et des fractions radicales lors de leur descente vers la Terre. Burke spécule que cette quatrième classe de réactions pourrait avoir un impact sur le flux de chaleur vers le véhicule, avec des implications importantes pour la conception de systèmes de protection thermique pour assurer la sécurité des astronautes et/ou des charges utiles lors de leur descente sur Terre.
En collaboration avec Stephen J. Klippenstein, (Division des sciences chimiques et du génie, Laboratoire National d'Argonne), Burke a utilisé des méthodes de calcul de pointe, combiner des calculs de chimie quantique qui simulent la rupture et la formation de liaisons chimiques entre les molécules en réaction avec des calculs de transport cinétique qui simulent les réactions et les mouvements des gaz en vrac qui régissent les performances des dispositifs d'ingénierie.
"La puissance de ces méthodes de calcul de pointe, " dit Burke, "est qu'ils peuvent fournir une lentille unique dans des environnements chimiques difficiles inadaptés aux techniques expérimentales d'étude de la dynamique de réaction individuelle. Nos calculs sont basés sur des données informatiques produites à partir de principes premiers :l'équation de Schrödinger, l'équation fondamentale de la mécanique quantique. La combinaison de ces données avec d'autres modèles basés sur la physique nous permet de déterminer directement l'impact d'une seule réaction parmi d'autres, d'une manière qui est très difficile à faire en laboratoire."
En utilisant des méthodes théoriques, y compris ceux qu'ils ont développés pour cette étude, les chercheurs ont montré que ces réactions chimiquement termoléculaires (c'est-à-dire à trois molécules) sont non seulement des voies chimiques majeures, mais ont également un impact sur les vitesses de propagation des flammes, une mesure de la réactivité globale du carburant qui régit les performances, stabilité, et l'efficacité de nombreux moteurs modernes.
La chimie de nombreux systèmes, y compris la combustion et les atmosphères planétaires, est régi par des mécanismes chimiques complexes, où la conversion globale d'un ensemble de réactifs initiaux en un ensemble de produits finaux passe par de nombreuses molécules chimiques intermédiaires avec de nombreuses réactions chimiques individuelles se produisant au niveau moléculaire. Notre compréhension actuelle des mécanismes complexes de la combustion et des atmosphères planétaires repose sur les classes de réactions connues. Jusqu'à maintenant, seules trois classes de réactions ont été considérées :
Le gaz du bain est généralement considéré comme un gaz inerte, ou non réactif, molécule qui ne participe à aucune rupture ou formation de liaison, mais enlève à la place de l'énergie de l'autre complexe moléculaire (qui aurait suffisamment d'énergie cinétique interne pour se décomposer spontanément si aucune énergie n'était retirée).
Si au contraire le complexe moléculaire entre en collision avec une molécule réactive, alors la troisième molécule peut participer au processus de rupture/formation de liaison, donnant ce que Burke et Klippenstein appellent un produit de « réaction chimique termoléculaire ». « Dans notre journal, nous avons montré l'importance des réactions impliquant des complexes H + O2 avec d'autres espèces radicalaires, par exemple. H + O2 + H, dans des environnements de combustion, " note-t-il. " Cependant, étant donné que les molécules réactives, comme les radicaux libres et l'oxygène moléculaire, sont des constituants majeurs de la combustion et de certains environnements planétaires, il existe un potentiel important pour que d'autres réactions chimiquement termoléculaires se produisent et jouent un rôle important dans d'autres environnements."
William H. Green, professeur de génie chimique au MIT, dit de l'étude, "On sait depuis longtemps que de nombreuses réactions d'association en phase gazeuse ont des taux d'efficacité très faibles, parce que l'adduit initial activé ne vit pas assez longtemps pour être stabilisé par un transfert d'énergie de collision, et s'effondre simplement aux réactifs. Cela a conduit le domaine à penser que ces adduits transitoires peuvent être complètement ignorés. Cet article révèle que même si les réactions unimoléculaires des adduits énergisés sont négligeables, ils peuvent encore participer à des réactions bimoléculaires, avec des conséquences étonnamment importantes."
Burke prévoit ensuite de généraliser ces théories et méthodes de calcul des taux de réaction chimiquement termoléculaires pour permettre des calculs similaires dans des environnements à pression plus élevée, où les collisions entre molécules sont encore plus fréquentes, important pour les conceptions de moteur de pointe. Il explorera également les implications de la découverte pour d'autres réactions et environnements chimiques, tels que ceux impliqués dans la formation et la réduction des polluants ou la chimie des atmosphères planétaires.