
Les chercheurs ont produit des images colorées sur des plaques de culture en utilisant du rouge, vert, et des lumières bleues pour contrôler le pigment produit par les bactéries avec une « vision multicolore ». La couleur de l'image a été corrigée dans Photoshop pour améliorer le contraste. Crédit :Félix Moser
Des chercheurs du MIT ont mis au point des bactéries dotées d'une « vision multicolore » — E. coli qui reconnaissent le rouge, vert, ou lumière bleue (RVB) et, en réponse à chaque couleur, exprimer différents gènes qui remplissent différentes fonctions biologiques.
Pour présenter la technologie, les chercheurs ont produit plusieurs images colorées sur des plaques de culture, dont l'une énonce « MIT », en utilisant des lumières RVB pour contrôler le pigment produit par la bactérie. En dehors du laboratoire, la technologie pourrait également s'avérer utile à des fins commerciales, pharmaceutique, et d'autres applications.
E. coli est programmé avec un système à base de protéines et d'enzymes, analogue à une puce informatique, avec plusieurs modules différents pour traiter l'entrée de lumière et produire une sortie biologique. En termes informatiques, un "réseau de capteurs" s'active d'abord en présence de rouge, vert, ou lumière bleue, et un "circuit" traite le signal. Puis, un « allocateur de ressources » relie les informations traitées à des « actionneurs » qui mettent en œuvre la fonction biologique correspondante.
Considérez les nouveaux E. coli comme des marionnettes microbiennes, avec de la lumière colorée au lieu de ficelles de marionnettes faisant agir les bactéries d'une certaine manière, déclare Chris Voigt, professeur de génie biologique au MIT, co-auteur d'un article dans Nature décrivant la technologie. "En utilisant différentes couleurs, nous pouvons contrôler différents gènes qui sont exprimés, " il dit.
Les co-auteurs de l'article sont d'anciens post-doctorants Jesus Fernandez-Rodriguez, Félix Moser, et Miryoung Song.
L'innovation en biologie synthétique se conjugue
En 2005, Voigt, qui co-dirige le Centre de biologie synthétique du MIT, et d'autres chercheurs ont mis au point une "caméra bactérienne" en programmant un capteur de lumière dans une souche d'E. coli, avec un gène qui a produit un pigment noir. Lorsque la lumière brillait à travers un pochoir sur une plaque recouverte de bactéries, les microbes formaient des images en noir et blanc. À l'époque, cet exploit n'a nécessité que quatre gènes et trois promoteurs, des régions d'ADN qui initient la transcription des gènes, pour faire le travail.
De nouveaux outils de biologie synthétique, comme le système d'édition du génome CRISPR, ont surgi depuis lors, ouvrant des possibilités plus larges aux chercheurs. Contrairement au système de 2005, le nouveau système RVB, le premier à utiliser trois couleurs, se compose de 18 gènes et de 14 promoteurs, entre autres, ainsi que 46, 000 paires de bases d'ADN.
Mais avec une plus grande complexité viennent de plus grands défis. Parce que les chercheurs avaient affaire à un réseau de capteurs capable de détecter trois couleurs distinctes, par exemple, ils ont dû inclure dans le programme microbien une protéine qui empêche la transcription génique des deux capteurs inutilisés.
En termes informatiques, c'est ce qu'on appelle une "porte NON, " un circuit qui produit un signal de sortie - dans ce cas, répression génique, uniquement lorsqu'il n'y a pas de signal sur son entrée. Avec des bactéries sous un feu rouge, par exemple, la porte NON déclencherait cette protéine répressive sur les capteurs vert et bleu, les éteindre.
Il y a environ cinq ans, Voigt a dirigé une équipe qui a conçu des microbes pour répondre à la lumière rouge et verte. L'ajout d'un troisième capteur était un défi majeur de la nouvelle recherche. " A l'intérieur de la cellule, tous les nouveaux capteurs de protéines que vous ajoutez interfèrent les uns avec les autres, parce que ce sont toutes les molécules qui se cognent autour de la cellule, et ils nécessitent tous de garder la cellule vivante et heureuse. Avec chaque capteur supplémentaire que vous ajoutez, qui devient exponentiellement plus difficile, " il dit.
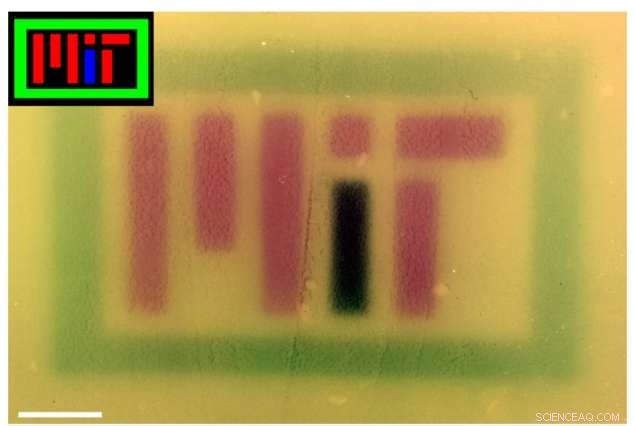
Des images colorées (encarts) ont été projetées sur des plaques de bactéries contenant le système RVB pour épeler « MIT ». La couleur de l'image a été corrigée dans Photoshop pour améliorer le contraste. Crédit :Félix Moser
À cet égard, Voigt ajoute, l'allocateur de ressources du système, une nouvelle fonctionnalité, fait également office de disjoncteur, éteindre les capteurs si les trois s'allument en même temps, surcharge de la cellule.
Du point de vue du génie génétique, la configuration à quatre sous-systèmes était « le plus grand impact de ce travail, " dit Voigt. Chaque sous-système - le réseau de capteurs, circuits, actionneurs de ressources, et actionneurs - a été conçu, construit, et optimisés isolément avant d'être assemblés en une structure finale. Ceci simplifié, processus modulaire pourrait ouvrir la voie à une programmation biologique plus complexe à l'avenir, selon les chercheurs.
En général, Voigt considère le nouveau système comme l'aboutissement d'une décennie d'innovations en biologie synthétique. "C'est une représentation de l'endroit où nous en sommes actuellement, et toutes les pièces qui ont dû être réunies au cours de la dernière décennie pour créer des systèmes de cette envergure et de cette complexité, " il dit.
Faire des "bactéries disco"
Pour créer les nouvelles images en couleur, les chercheurs ont programmé des bactéries pour produire le même pigment que le rouge, vert, ou la lumière bleue les éclairait. Dans un incubateur, les chercheurs ont recouvert une boîte de Pétri de bactéries génétiquement identiques. "Vous pouvez le voir comme un film non développé, où vous avez la boîte de Pétri avec des bactéries dessus, " Voigt dit, "et la caméra est l'incubateur."
Au sommet de l'incubateur se trouve un trou, où une image au pochoir est projetée sur la plaque. Heures supplémentaires, les bactéries se développent, produisant une enzyme qui produit un pigment correspondant à la couleur RBG par laquelle ils sont illuminés. En plus du logo MIT, les chercheurs ont produit des images de divers motifs, fruits multicolores, et le personnage de jeu vidéo Super Mario.
Les bactéries modifiées pourraient également être utilisées pour démarrer et arrêter rapidement les réactions chimiques des microbes dans les processus de fermentation industriels, qui sont utilisés pour fabriquer des produits pharmaceutiques et d'autres produits. Aujourd'hui, contrôler de telles réactions chimiques nécessite de vider différents additifs chimiques dans de grandes cuves de fermentation, ce qui est chronophage et inefficace.
Dans leur papier, les chercheurs ont démontré ce concept de « produits chimiques à la demande » à petite échelle. En utilisant les outils d'édition de gènes CRISPR, ils ont modifié trois gènes qui produisent de l'acétate - un sous-produit parfois indésirable de divers bioprocédés - pour produire moins de produit chimique en réponse aux lumières RVB.
"Individuellement, et en combinaison les uns avec les autres, les différentes couleurs de lumière réduisent la production d'acétate sans sacrifier l'accumulation de biomasse, ", ont écrit les chercheurs dans leur article.
Voigt a inventé un nom amusant pour ces microbes industriels. "Je les appelle 'bactéries disco, '" il dit, "parce que différentes lumières colorées clignotent à l'intérieur du fermenteur et contrôlent les cellules."
Une future application, Voigt ajoute, pourrait être dans le contrôle des cellules pour former divers matériaux et structures. Des chercheurs, dont certains au MIT, ont commencé à programmer des cellules à assembler en matériaux vivants qui pourraient un jour être utilisés pour concevoir des cellules solaires, matériaux auto-cicatrisants, ou des capteurs de diagnostic.
"C'est incroyable quand vous regardez le monde et voyez tous les différents matériaux, " dit Voigt. " Des choses comme la cellulose, protéines de soie, métaux, nanofils, et les matériaux vivants comme les organes – toutes ces différentes choses dans la nature que nous obtenons des cellules qui se développent selon différents modèles. Vous pouvez imaginer utiliser différentes couleurs de lumière pour indiquer aux cellules comment elles devraient se développer dans le cadre de la construction de ce matériau. »
Cette histoire est republiée avec l'aimable autorisation de MIT News (web.mit.edu/newsoffice/), un site populaire qui couvre l'actualité de la recherche du MIT, innovation et enseignement.