
Crédit :Wikipédia commons
L'un des plus grands défis de la biologie aujourd'hui est d'expliquer la structure des crêtes, les membranes internes des mitochondries. Une explication dans ce cas est un ensemble de principes pour prédire quelle forme les crêtes prendront après des manipulations métaboliques de base de l'environnement dans lequel se trouvent les mitochondries. Ces principes seront donc une description de la véritable fonction des mitochondries, quelque chose qui n'a jusqu'à présent que été à peine imaginé.
Les avancées récentes dans des techniques telles que la microscopie optique à super-résolution de cellules vivantes et la tomographie électronique ont donné un nouvel aperçu du comportement dynamique des crêtes. Une architecture détaillée de l'ensemble du volume mitochondrial peut maintenant être construite à partir d'une série d'images d'inclinaison qui sont rétroprojetées pour créer des tomogrammes 3D. Lundi, nous avons discuté de la façon dont les crêtes sont transformées et reconfigurées en fonction de l'abondance et de la santé de plusieurs protéines de la membrane interne et de la matrice. Le prétexte de cette analyse était les similitudes structurelles et biochimiques entre les membranes des mitochondries, les thylakoïdes et la myéline qui aident vraisemblablement à canaliser les métabolites dans la production d'énergie.
Dans un article récent de Open Biology de la Royal Society , les chercheurs expliquent la biogenèse des crêtes par les activités coordonnées de quatre voies majeures qui sont préservées au cours de l'évolution depuis les protistes et les levures jusqu'aux eucaryotes supérieurs comme nous :formation de dimères et oligomérisation de l'ATP synthase au bord des crêtes, assemblage du « site de contact mitochondrial ». et le système d'organisation des crêtes (MICOS) aux jonctions des crêtes, le remodelage de la membrane par une GTPase associée à la membrane interne et liée à la dynamine (Mgm1 chez la levure et OPA1 chez les mammifères) et un ajustement approprié de la composition lipidique de la membrane.
Pour la première voie impliquant l'ATP-synthase, plusieurs choses ressortent. Comme nous l'avons signalé précédemment, la dimérisation spontanée de l'ATP-synthase à des angles précisément définis et dépendant de l'espèce en rangées ordonnées dicte la géométrie du rez-de-chaussée. Contrairement aux complexes respiratoires I-IV, qui sont assemblés sur la membrane limite interne plate, l'ATP-synthase (complexe V) est entièrement assemblée profondément dans les membranes des crêtes. Alors que plusieurs protéines de la sous-unité ATP-synthase sont indispensables pour la formation correcte des crêtes, les sous-unités Atp20 et Atp21 sont strictement nécessaires.
Un excès d'ADP induit une conformation condensée avec de grands espaces intra-cristallins gonflés. En revanche, dans des conditions limitant l'ADP, les mitochondries adoptent la conformation orthodoxe avec un espace intra-cristallin contracté. Chez l'amibe géante Chaos carolinensis, les mitochondries contiennent normalement des crêtes tubulaires orientées au hasard. Avec la famine, les crêtes élargies adoptent une morphologie cubique avec un motif en zigzag. Chez la souris, les agents apoptotiques provoquent la fusion de crêtes individuelles avec la libération ultérieure de cytochrome c de l'espace intra-cristal dans la région limite.
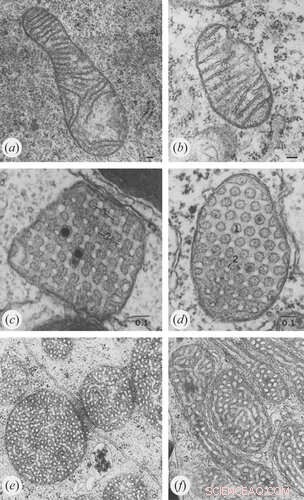
Crédit :Klecker et Westermann, Open Biology (2021). DOI :10.1098/rsob.210238
Pour la deuxième voie, l'assemblage des sites de contact MICOS, la recherche a déterminé que des protéines critiques telles que celles de la famille de gènes liés à MIC60 sont présentes dès les ancêtres endosymbiotiques des mitochondries, les α-protéobactéries. Beaucoup de ces précurseurs mitochondriaux antérieurs présentent déjà des structures membranaires intracytoplasmiques différenciées. Invariablement, les espèces qui ont simplifié leurs mitochondries au point que les crêtes sont absentes manquent en conséquence des gènes liés à MICOS. La réexpression d'homologues de MIC60 dans des mutants de levure Δmic60 sauve les défauts mitochondriaux ultrastructuraux.
La troisième voie comprend les GTPases liées à la dynamine, qui coordonnent la fusion et la fission des membranes internes et externes. Lors de la fission, ces protéines se polymérisent en anneaux contractiles qui appliquent des forces de constriction pour comprimer les mitochondries. On comprend maintenant que le résultat dépend des interactions de ces protéines, à la fois avec le complexe MICOS et les jonctions de crêtes, ainsi qu'avec les systèmes de transport membranaire interne et externe qui s'y rassemblent. Ceux-ci incluent les complexes translocateurs membranaires TIM et TOM.
La quatrième voie comprend les phospholipides membranaires mitochondriaux eux-mêmes. Les mitochondries abritent la voie de biosynthèse de la cardiolipine et sont également impliquées dans la synthèse de la phosphatidyléthanolamine. Avec la phosphatidylcholine, ce sont les trois principaux phospholipides avec lesquels les mitochondries travaillent. La plupart des éléments constitutifs des lipides mitochondriaux sont synthétisés dans le RE et doivent donc être importés par des mécanismes impliquant une apposition étroite au RE. Une fois à l'intérieur de la membrane externe, la distribution des lipides est médiée par des protéines de transport localisées dans l'espace intermembranaire de la famille Ups/PRELI,
Les mitochondries ne créent pas de géométrie à partir de zéro, mais exploitent et s'appuient plutôt sur les formes physiques naturelles qui se produisent spontanément dans les lipides. Laissés à eux-mêmes, les lipides forment des structures lamellaires concentriques qui peuvent ensuite être expansées et augmentées par des protéines spécifiques. Des mesures à petite échelle ont maintenant révélé que les crêtes individuelles sont fonctionnellement indépendantes et peuvent avoir des potentiels de membrane très différents.
La formation de Cristae implique une interaction étroitement liée des quatre influences de mise en forme ci-dessus. For example, the activities of the MICOS complex and ATP synthase dimerization are both cooperative and antagonistic. MICOS induces negative membrane curvature while the ATP synthase induces positive curvature at cristae tips and rims. New computational models, as currently under development in labs throughout the world, where ratios of these different components can be finely tweaked and adjusted, will greatly aid in defining what controls the form of mitochondria.