Crédit :Wiley
L'édition de gènes est l'un des sujets les plus brûlants de la recherche sur le cancer. Une équipe de recherche chinoise a maintenant développé un véhicule multifonctionnel à base de nanoparticules d'or pour transporter les « ciseaux de gènes » vers le génome de la cellule tumorale. Comme le rapportent les auteurs dans la revue Angewandte Chemie , leur plate-forme de transport et de libération non virale de systèmes d'édition de gènes a l'avantage supplémentaire de combiner la thérapie hyperthermique du cancer avec la modification génétique.
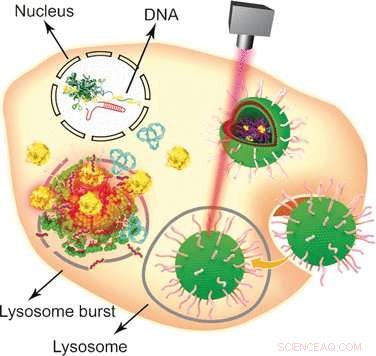
Depuis sa découverte en 2002, la stratégie de défense antivirale bactérienne CRISPR-Cas9 est devenue l'une des approches d'ingénierie du génome les plus populaires avec de larges applications dans les domaines de la biologie moléculaire et de la biomédecine. En utilisant le système CRISPR-Cas9, un gène cible peut être édité, assommé, ou inséré dans des cellules eucaryotes d'une manière relativement simple et pratique. Cependant, l'un de ses points faibles est sa taille, qui exige l'utilisation de véhicules non viraux spécifiques pour délivrer le grand plasmide au noyau. Combinant des formulations lipidiques établies avec des nanoparticules d'or, Wenfu Zheng et ses collègues du National Center for NanoScience and Technology, Pékin, Chine, en coopération avec des scientifiques médicaux au Japon et en Chine, ont trouvé et testé un outil multifonctionnel basé sur des composants simples qui délivrent et libèrent efficacement le système CRISPR-Cas9 dans les tumeurs. L'irradiation laser a été utilisée pour désassembler le véhicule lipide-nanogold après son entrée dans les cellules tumorales et permettre l'édition du gène CRISPR-Cas9. Le knock-out du gène ciblé a ensuite conduit à l'apoptose et à l'inhibition de la croissance tumorale.
Les nanoparticules d'or sont des supports particulièrement intéressants pour diverses molécules biologiques en raison de leur modification facile, stabilité, et la réponse à l'irradiation lumineuse. Pour les convertir en un véhicule biologique polyvalent de transport et de livraison, les scientifiques ont d'abord attaché des peptides Tat, qui facilitent la traversée de la membrane du noyau cellulaire, à des nanoparticules d'or. Puis, le plasmide CRISPR-Cas9 contenant l'ARN ciblant le gène Plk-1 - dont le knock-out altérerait gravement la fonction des cellules tumorales - a été attaché aux peptides Tat par des interactions électrostatiques afin qu'ils libèrent leur charge juste après leur entrée dans le noyau. Finalement, le système nanoparticulaire a été recouvert d'une formulation de lipides pour améliorer l'absorption cellulaire.
Pour tester le système, les cellules et les souris porteuses de tumeurs ont toutes deux été administrées avec le véhicule nanogold porteur de plasmide CRISPR-Cas9, et la libération de la machine d'édition de gènes a été déclenchée par un laser. "Dans cette étude, l'irradiation lumineuse a provoqué la libération du peptide Tat des nanoparticules d'or d'une manière dépendante du temps et de l'intensité laser, " expliquent les auteurs. D'autres approches sont également possibles comme ils l'ont souligné :comme les nanoparticules d'or s'échauffent lors de l'irradiation, ils pourraient eux-mêmes servir d'agents thermothérapeutiques. En résumé, cette conception relativement simple impliquant des nanoparticules d'or, peptides, et les lipides assemblés dans un système de support/libération multifonctionnel sophistiqué pourraient servir de plate-forme d'administration multifonctionnelle pour divers aspects de la thérapie génique.