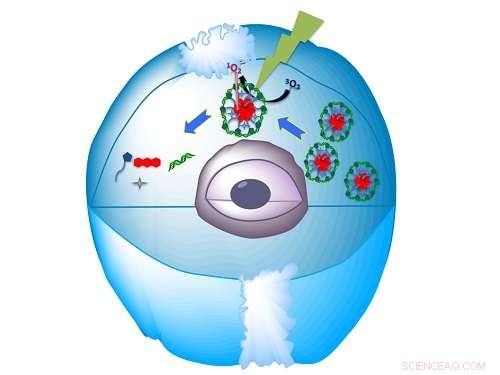
Le nanomatériau biocompatible auto-assemblé délivre le miARN dans la cellule, puis le libère lorsqu'il est frappé par la lumière. Crédit :KAUST
Un petit système d'administration thérapeutique capable de contrôler la capacité du corps à fabriquer des protéines a été développé par des chercheurs de l'Université des sciences et technologies du roi Abdallah (KAUST) d'Arabie saoudite.
Les gènes contiennent les instructions pour fabriquer les protéines qui composent notre corps. L'information génétique est traduite en protéines nécessaires à la construction de cellules vivantes grâce à un processus de transcription dans lequel le code génétique de l'ADN est copié dans une grosse molécule connue sous le nom d'ARN messager (ARNm).
Ce processus de transcription peut être modifié en introduisant de courts doubles brins d'ARN, appelé petit ARN interférent (siRNA), qui se lie à l'ARNm et inhibe l'expression de gènes particuliers. L'exploitation de cette interférence ARN pour des applications thérapeutiques est difficile et nécessite un matériau capable de protéger le siARN lors de son passage dans la circulation sanguine, l'aidant à pénétrer la membrane externe de la cellule et à la livrer à son emplacement cible.
« La livraison d'ARN est très délicate car elle peut être facilement digérée par les cellules. De meilleurs véhicules sont nécessaires pour que plus d'ARN puisse être délivré afin de modifier les gènes, " déclare Niveen Khashab du laboratoire de matériaux hybrides intelligents KAUST.
Khashab et ses collègues ont maintenant démontré des nanostructures biocompatibles pour délivrer des siARN et faire taire efficacement les gènes1. Ils ont combiné la macromolécule histidine-coiffée-9, 10-dialcoxy-anthracène (HDA) et siRNA dans l'eau. Ils ont observé l'auto-assemblage de nanoparticules sphériques lorsque l'eau était légèrement acide, mais pas quand il était à pH neutre.
Khashab explique que ces nanosphères sont créées par l'interaction électrostatique entre le HDA chargé positivement et l'ARN chargé négativement, puis les deux longs bras du supramoléculaire HDA s'enroulent autour du siRNA pour le protéger.
"Notre lieur organique est capable d'interagir avec le matériel génétique par des liaisons hydrogène et de former un véhicule de livraison, " explique Khashab. " L'approche est évolutive et crée des quantités reproductibles d'ARN encapsulé; il est également biocompatible et sûr."
Les nanoparticules pourraient également être activées avec la lumière visible. Lorsqu'il est irradié par un rayonnement vert en présence d'un composé fluorescent acide, connu sous le nom d'éosine, la sphère se désassemble et libère le siRNA.
L'équipe a montré l'efficacité de la nanoparticule pour l'administration de médicaments sur le lymphome à cellules B 2, une molécule d'ARNm qui crée des protéines pour réguler la mort cellulaire. Ils ont montré que leurs nanostructures améliorent l'efficacité de l'inactivation des gènes et entraînent une suppression des gènes de plus de 90 % après exposition à la lumière visible.
"La prochaine étape consiste à peaufiner la conception pour fournir d'autres molécules de cargaison telles que les protéines et améliorer la réponse lumineuse à une longueur d'onde plus élevée dans le proche infrarouge, " dit Khashab.