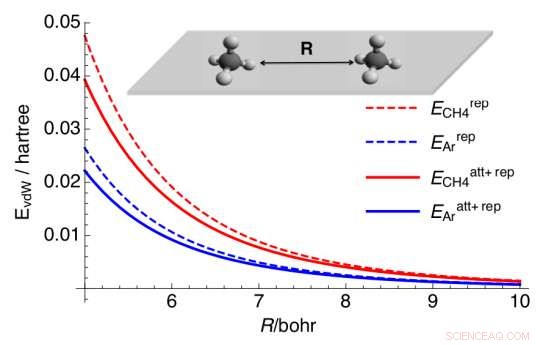
Interaction répulsive de l'état fondamental E rep (traits pleins) et somme de l'énergie de répulsion et d'attraction de Londres (E att) (traits interrompus) pour les dimères d'argon et de méthane sur une surface parfaitement réfléchissante. Crédit :arXiv:1610.09275 [cond-mat.mes-hall]
Les interactions de Van der Waals entre les molécules sont parmi les forces les plus importantes en biologie, la physique, et la chimie, car ils déterminent les propriétés et le comportement physique de nombreux matériaux. Pendant longtemps, il a été considéré que ces interactions entre molécules sont toujours attractives. Maintenant, pour la première fois, Mainak Sadhukhan et Alexandre Tkatchenko de l'Unité de recherche en physique et science des matériaux de l'Université du Luxembourg ont découvert que dans de nombreuses situations assez courantes dans la nature, la force de van der Waals entre deux molécules devient répulsive. Cela pourrait conduire à un changement de paradigme dans les interactions moléculaires.
"Les manuels supposaient jusqu'à présent que les forces sont uniquement attractives. Pour nous, la question intéressante est de savoir si vous pouvez aussi les rendre répulsifs, " explique le professeur Tkatchenko. " Jusqu'à récemment, il n'y avait aucune preuve dans la littérature scientifique que les forces de van der Waals pourraient également être repoussantes. les chercheurs ont montré dans leur article, publié dans la revue scientifique de renom Lettres d'examen physique , que les forces sont, En réalité, répugnantes lorsqu'elles se déroulent sous confinement.
L'omniprésente force de van der Waals a été expliquée pour la première fois par le physicien germano-américain Fritz London en 1930. À l'aide de la mécanique quantique, il a prouvé la nature purement attractive de la force de van der Waals pour deux molécules interagissant dans l'espace libre. "Toutefois, dans la nature, les molécules interagissent dans la plupart des cas dans des espaces confinés, comme les cellules, membranes, nanotubes, etc. Dans cette situation particulière, les forces de van der Waals deviennent répulsives à de grandes distances entre les molécules, ", explique le professeur Tkatchenko.
Mainak Sadhukhan, le co-auteur de l'étude, ont développé une nouvelle méthode de mécanique quantique qui leur a permis de modéliser les forces de van der Waals en confinement. "Nous pourrions rationaliser de nombreux résultats expérimentaux antérieurs qui restaient inexpliqués jusqu'à présent. Notre nouvelle théorie permet, pour la première fois, pour une interprétation de nombreux phénomènes intéressants observés pour les molécules sous confinement, " dit Mainak Sadhukhan.
La découverte pourrait avoir de nombreuses implications potentielles pour l'administration de molécules pharmaceutiques dans les cellules, le dessalement et le transport de l'eau, et l'auto-assemblage de couches moléculaires dans les dispositifs photovoltaïques.
Le groupe de recherche du professeur Tkatchenko travaille sur des méthodes qui modélisent les propriétés d'un large éventail d'interactions intermoléculaires. Seulement en 2016, ils ont découvert que la vraie nature de ces forces de van der Wals diffère de la sagesse conventionnelle en chimie et en biologie, car ils doivent être traités comme un couplage entre les ondes plutôt que comme une attraction (ou répulsion) mutuelle entre les particules.