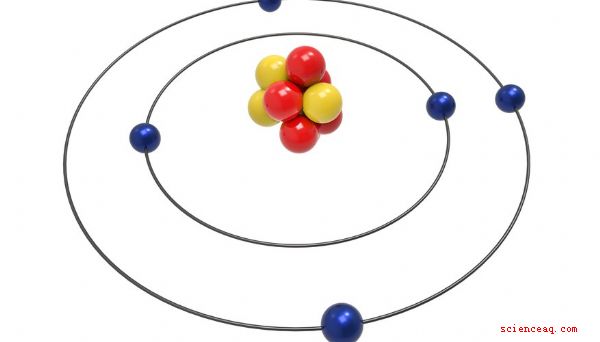
Les atomes constituent toute la matière. Tout ce qui a de la masse et du volume, grand ou petit, contient des atomes. Étonnamment, les minuscules atomes contiennent des particules encore plus petites. Les protons, les neutrons et les électrons sont les trois principaux composants de tous les atomes. Le nombre et la disposition de ces trois particules incroyablement petites déterminent les propriétés et le comportement des atomes qui les contiennent.
TL; DR (Trop long; n'a pas lu)
Pour trouver le nombre des neutrons dans un isotope, soustrayez le nombre de protons de la masse atomique de l'isotope. Le numéro atomique de l'élément est égal au nombre de protons. Le calcul du nombre de neutrons devient alors la masse atomique de l'isotope moins le numéro atomique de l'élément est égal au nombre de neutrons. Pour l'uranium 235, numéro atomique 92, le nombre de neutrons est de 235 à 92 \u003d 143, ou 143 neutrons.
Particules dans les atomes
Presque tous les atomes contiennent trois particules principales: protons, neutrons et électrons. Les protons et les neutrons constituent le noyau, ou centre, de l'atome. Les électrons, beaucoup plus petits que les protons et les neutrons, encerclent le noyau, se déplaçant à la vitesse de la lumière. Les protons ont une charge positive, les neutrons n'ont pas de charge et les électrons ont une charge négative. Dans un atome neutre, le nombre de protons est égal au nombre d'électrons, mais le nombre de neutrons n'est pas toujours égal au nombre de protons.
Identification des atomes
Le nombre de protons dans un atome détermine quels type d'élément que l'atome forme. L'hydrogène, premier élément du tableau périodique, n'a qu'un seul proton. L'hélium, deuxième du tableau périodique, possède deux protons. L'or, numéro 79 sur le tableau périodique, compte 79 protons. Le tableau périodique des éléments montre les éléments dans l'ordre du nombre de protons dans les atomes.
Isotopes d'atomes
Un isotope d'un élément signifie des atomes avec le même numéro atomique mais des nombres de masse différents. Ainsi, les isotopes d'un élément ont un nombre différent de neutrons. "Hydrogen has three isotopes.", 3, [[L'hydrogène, la forme la plus courante de l'atome, possède un proton et un électron. Le deutérium, un isotope de l'hydrogène, n'a toujours qu'un proton et un électron, mais aussi un neutron. Le tritium, un autre isotope de l'hydrogène, n'a toujours qu'un proton et un électron mais a deux neutrons.
Calcul des neutrons
La masse d'un atome est constituée des masses combinées des protons et des neutrons. La masse des électrons est négligeable dans la masse globale de l'atome. Les protons mesurent environ une unité de masse atomique et les neutrons ne mesurent que légèrement plus d'une unité de masse atomique. Pour trouver le nombre de neutrons dans l'atome, soustrayez le numéro atomique de la masse atomique.
Le numéro atomique et la masse atomique moyenne se trouvent sur le tableau périodique. Cependant, la masse des différents isotopes est souvent inscrite dans le nom de l'isotope. L'uranium-235 signifie que l'uranium élément, numéro atomique 92, a 92 protons et une masse atomique de 235. D'autre part, l'uranium-238 a une masse de 238 mais n'a toujours que 92 protons. Une autre méthode d'écriture d'un isotope montre la masse atomique en exposant et le numéro atomique en indice. L'uranium 235 pourrait également s'écrire 235 92 U où U est l'abréviation standard pour l'uranium. En utilisant les isotopes d'hydrogène comme exemples, l'atome d'hydrogène "normal" a une masse atomique de 1, et le numéro atomique est 1, ce qui signifie que l'atome n'a qu'un seul proton. En utilisant la formule, la masse atomique de 1 moins le nombre atomique, ou nombre de protons, de 1 donne l'équation 1-1 \u003d 0, donc l'atome d'hydrogène a 0 neutrons. En revanche, le tritium, un isotope de l'hydrogène, a une masse atomique de 3 mais le numéro atomique de l'hydrogène reste 1 car l'atome n'a qu'un seul proton. En utilisant l'équation, la masse atomique moins le numéro atomique est égal au nombre de neutrons, donne 3-1 \u003d 2, donc le tritium a 2 neutrons. Un autre élément commun, le carbone, a également plusieurs isotopes. L'atome de carbone normal, numéro atomique 6, a une masse atomique de 12. En utilisant la formule, la masse atomique moins le numéro atomique est égal au nombre de neutrons, montre 12-6 \u003d 6, donc l'atome de carbone 12 a 6 neutrons. Le carbone 14, utilisé pour la datation de l'âge radioactif des fossiles de moins de 10 000 ans, a toujours 6 protons mais a une masse atomique de 14. Le calcul du nombre de neutrons utilise la même formule, donc 14-6 \u003d 8, donc le carbone 14 a 8 neutrons dans son noyau.