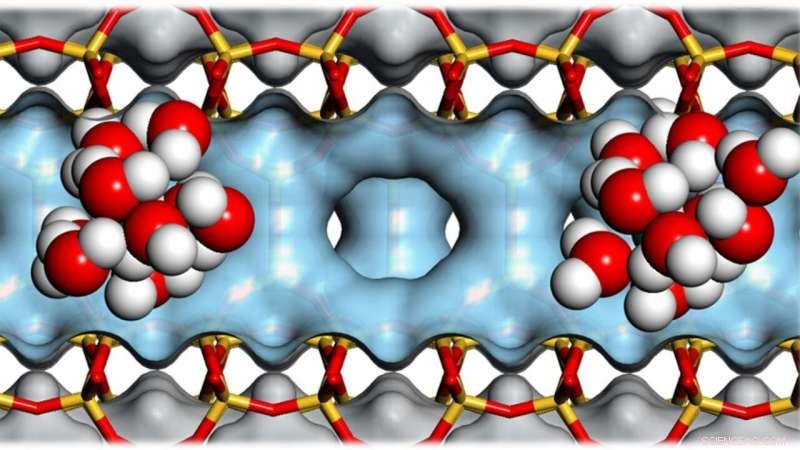
Des amas de molécules d'eau dans les cavités des zéolithes aident à catalyser la conversion de la biomasse en biocarburant. Crédit :Andreas Jentys / TUM
Les zéolites sont des matériaux extrêmement poreux :dix grammes peuvent avoir une surface interne de la taille d'un terrain de football. Leurs cavités les rendent utiles pour catalyser des réactions chimiques et ainsi économiser de l'énergie. Une équipe de recherche internationale a maintenant fait de nouvelles découvertes concernant le rôle des molécules d'eau dans ces processus. Une application importante est la conversion de la biomasse en biocarburant.
Le carburant issu de la biomasse est considéré comme climatiquement neutre, bien qu'il faille encore de l'énergie pour le produire :Les réactions chimiques souhaitées nécessitent des niveaux élevés de température et de pression.
« Si nous voulons à l'avenir nous passer des sources d'énergie fossiles et utiliser efficacement et à grande échelle la biomasse, il faudra aussi trouver des moyens de réduire l'énergie nécessaire au traitement de la biomasse, " dit Johannes Lercher, professeur de technologie chimique à l'Université technique de Munich (TUM) et directeur de l'Institute for Integrated Catalysis au Pacific Northwest National Laboratory à Richland, Washington (États-Unis).
En collaboration avec une équipe de recherche internationale, Lercher s'est penché de plus près sur le rôle des molécules d'eau dans les réactions à l'intérieur des pores de la zéolite, dont la taille est inférieure à un nanomètre.
Tout commence avec des acides
Une caractéristique d'un acide est qu'il donne facilement des protons. Ainsi, lorsqu'il est ajouté à l'eau, l'acide chlorhydrique se divise en anions chlorure chargés négativement, comme ceux trouvés dans les cristaux de sel de table, et des protons chargés positivement qui s'attachent aux molécules d'eau. Il en résulte un ion hydronium chargé positivement, qui cherche à transmettre davantage ce proton, par exemple à une molécule organique.
Lorsque la molécule organique est « forcée » d'accepter un proton, il essaie de se stabiliser. Ainsi, un alcool peut donner naissance à une molécule avec une double liaison, une étape de réaction typique sur le chemin de la biomasse au biocarburant. Les parois de zéolithe stabilisent les états de transition apparaissant lors de la conversion et, Donc, aider à minimiser la quantité d'énergie requise pour que la réaction se produise.

Le professeur Lercher dans son laboratoire du Département de chimie de l'Université technique de Munich. Crédit :Andreas Heddergott / TUM
Zéolites agissant comme acides
Les zéolithes contiennent des atomes d'oxygène dans leur structure cristalline qui portent déjà un proton. Comme les acides moléculaires, ils forment des ions hydronium par interaction avec l'eau.
Cependant, tandis que les ions hydronium se dispersent dans l'eau, ils restent étroitement associés à la zéolithe. Le prétraitement chimique peut faire varier le nombre de ces centres actifs et, Donc, établir une certaine densité d'ions hydronium dans les pores de la zéolithe.
La zéolite idéale pour chaque réaction
En variant systématiquement la taille des cavités, la densité des sites actifs et la quantité d'eau, l'équipe de recherche a pu élucider les tailles de pores et les concentrations d'eau qui ont le mieux catalysé des exemples de réactions sélectionnées.
"En général, il est possible d'augmenter la vitesse de réaction en réduisant les pores et en augmentant la densité de charge, " explique Johannes Lercher. " Cependant, cette augmentation a ses limites :lorsque les choses sont trop encombrées et que les charges sont trop proches les unes des autres, la vitesse de réaction chute à nouveau. Cela permet de trouver les conditions optimales pour chaque réaction."
« Les zéolithes conviennent généralement comme nanoréacteurs pour toutes les réactions chimiques dont les partenaires réactionnels s'insèrent dans les pores et dans lesquelles un acide est utilisé comme catalyseur, " souligne Lercher. " Nous sommes au tout début d'un développement avec le potentiel d'augmenter la réactivité des molécules même à basse température et, Donc, pour économiser des quantités considérables d'énergie dans la production de carburants ou de produits chimiques.