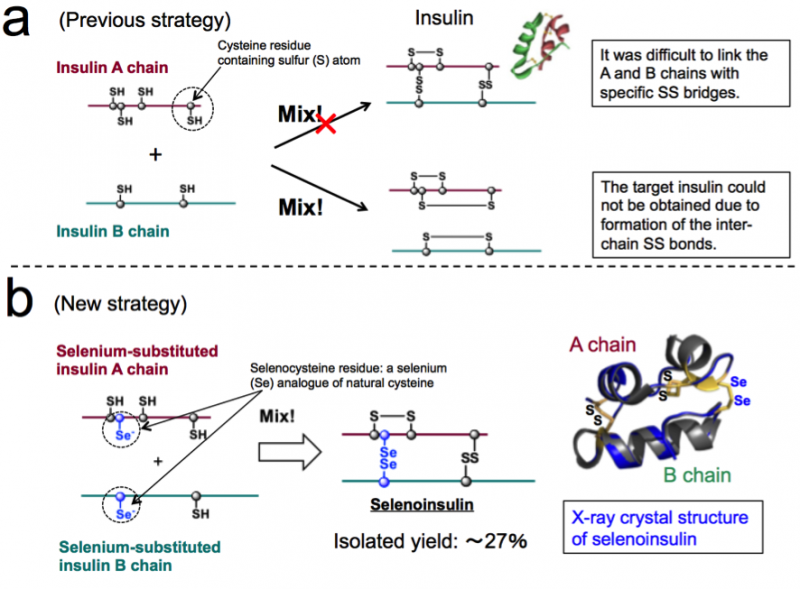
Figure 1. Synthèse chimique de l'insuline. (a) Stratégie précédente basée sur le couplage entre les chaînes A et B de l'insuline native. (b) Nouvelle stratégie exploitant la nature unique de la sélénocystéine et la structure cristalline aux rayons X de la sélénoinsuline. (Ces chiffres sont tirés de l'article original avec des modifications.). Crédit :Université d'Osaka
Un groupe de chercheurs a développé des analogues synthétiques de l'insuline séléno-insuline (Se-Ins) en remplaçant le disulfure interchaîne dans l'insuline pancréatique bovine (BPIns) par un pont diséléniure.
Ce groupe a démontré que les Se-Ins avaient une structure presque identique et une bioactivité comparable à celles des BPins, et qu'il avait une résistance accrue à la dégradation de l'IDE. Cela est prometteur pour l'application de Se-Ins à une préparation d'insuline de longue durée dans le traitement du diabète.
Après avoir circulé dans la circulation sanguine, l'insuline est dégradée par une enzyme de dégradation de l'insuline (IDE) dans les reins et excrétée dans l'urine. Ce groupe pensait que la production d'insuline à haute résistance à la dégradation par l'IDE conduirait au développement d'un nouveau type de préparations d'insuline de longue durée qui pourraient circuler dans l'organisme pendant longtemps.
L'insuline est constituée de deux chaînes polypeptidiques :une chaîne et une chaîne B, reliés par une liaison disulfure (liaison Se-Se), il est donc difficile de prendre de l'insuline uniquement à partir de ces chaînes en raison des liaisons Se-Se. Ainsi, ce groupe pensait que si les chaînes A et B de l'insuline contenant du sélénium (Se) au lieu du soufre (S), ont été utilisées, la liaison diséléniure (liaison Se-Se) serait formée rapidement et la réaction d'assemblage en chaîne pourrait alors être effectuée efficacement, comme Se est plus réactif que S.
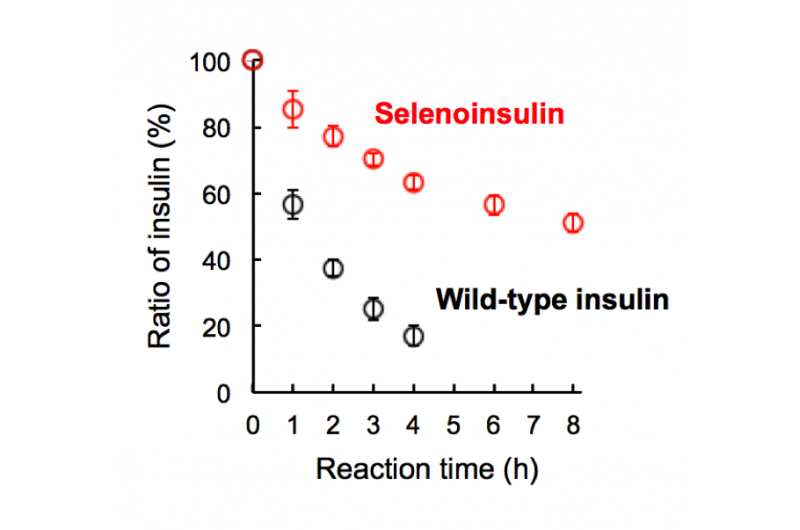
Figure 2. Dégradation de la séléno-insuline (rouge) et de l'insuline de type sauvage (noir) par l'enzyme de dégradation de l'insuline (IDE). (Ce chiffre a été cité de l'article original avec de légères modifications.). Crédit :Université d'Osaka
En outre, Les liaisons Se-Se sont plus stables que les liaisons S-S, donc ce groupe a prévu que les liaisons Se-Se donneraient une robustesse structurelle supplémentaire sur le pli de l'insuline, résultant ainsi en une résistance accrue à la dégradation de l'IDE en raison de sa stabilité intrinsèque. Sur la base de ce concept, ce groupe a réussi à synthétiser des chaînes A et B d'insuline contenant du Se, ainsi que l'obtention de Se-Ins avec un rendement d'isolement allant jusqu'à 27% en faisant réagir des chaînes peptidiques dans des conditions optimales.
Ce groupe a démontré que les Se-Ins avaient une structure presque identique à celle des BPIns, suggérant que Se-Ins a une bioactivité comparable à celle des BPIns. Des expériences de dégradation des BPIns et des Se-Ins en utilisant l'IDE ont montré que le taux de dégradation des Se-Ins était beaucoup plus lent que celui des BPIns. De là, on pense que Se-Ins a une nature durable et pourrait être une nouvelle classe d'analogues de l'insuline à action prolongée pour le traitement du diabète.
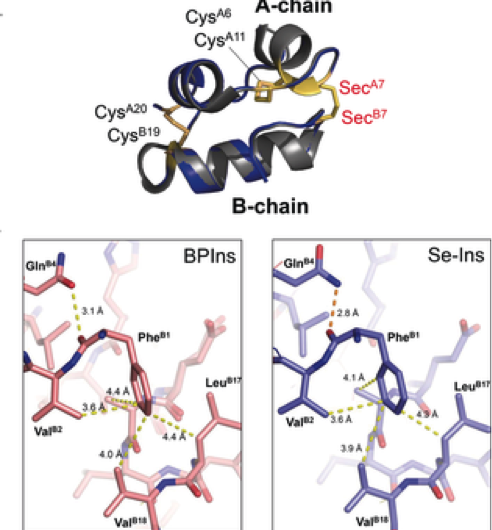
Figure 3. Préparation de la séléno-insuline en tant qu'analogue de l'insuline de longue durée. Crédit :Université d'Osaka