Des chercheurs de l'Université autonome de Barcelone (UAB) ont développé des nanozymes minimes capables de capturer le dioxyde de carbone (CO2 ) émis dans les processus industriels - et applicable à d'autres processus de dépollution environnementale - basés sur des structures moléculaires artificielles formées par les peptides de seulement sept acides aminés.
Ces nouvelles molécules pourraient également agir comme métalloenzymes, ce qui ouvre de nouvelles possibilités dans la recherche en biotechnologie. L'étude apporte également une nouvelle contribution à l'origine de l'activité catalytique au début de la vie.
La recherche, avec Salvador Ventura comme coordinateur et Susanna Navarro comme premier auteur, a été récemment publiée dans ACS Nano. . Tous deux sont chercheurs à l'Institut de biotechnologie et de biomédecine et au Département de biochimie et de biologie moléculaire de l'UAB, et ont travaillé ensemble dans l'étude avec des chercheurs du Département de chimie de l'UAB et du Centre de recherche bioGUNE.
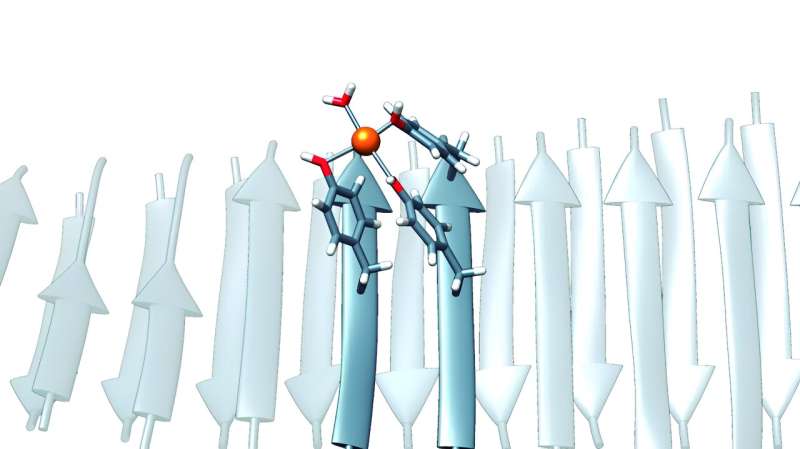
En 2018, les chercheurs de l’UAB sont parvenus à créer des molécules très courtes capables de s’auto-assembler, inspirées de la capacité naturelle à s’auto-assembler des fibrilles amyloïdes, et basées sur un séquençage spécifique de protéines prions. Ces amyloïdes artificiels ont des activités catalytiques, avec des avantages tels que la modularité, la flexibilité, la stabilité et la réutilisation par rapport aux enzymes naturelles.
Aujourd'hui, les chercheurs ont découvert leur capacité à se lier efficacement aux ions métalliques et à agir comme éléments de stockage des métaux et des métalloenzymes.
"Ces peptides étaient particuliers, car ils ne contenaient pas les acides aminés typiques, tels que l'histidine, qui sont souvent considérés comme essentiels à la coordination des ions métalliques dans les enzymes, et que l'on pensait essentiels à l'activité catalytique. En revanche, ils étaient enrichi de résidus de tyrosine, un élément qui, bien que moins connu dans ce contexte, peut également avoir la capacité unique de se lier à des ions métalliques s'il se trouve dans le contexte structurel correct. C'est la capacité de la tyrosine à le faire, c'est ce que nous avons utilisé pour créer nos nanozymes. ", a déclaré Ventura.
Les résultats peuvent être appliqués à plusieurs domaines. Premièrement, les nanozymes sont stables et peuvent être utilisées pour l'assainissement de l'environnement, dans les processus de traitement des eaux usées ou dans les sols contaminés, compte tenu de leur capacité remarquable à séquestrer les ions métalliques.
Deuxièmement, ils peuvent fonctionner comme des métalloenzymes, capables de catalyser des réactions dans des conditions dans lesquelles les enzymes actuelles, beaucoup moins stables, seraient incapables d'agir. Cela ouvre de nouvelles possibilités dans la recherche en biotechnologie, par exemple dans la catalyse de réactions à des températures et des pH extrêmes.
Sur la base des nanozymes qu'ils ont conçus, les chercheurs sont convaincus d'avoir développé avec succès une variante minimaliste d'une enzyme anhydrase carbonique capable de stocker efficacement le CO2 émis par les gaz à effet de serre, et à un coût de production bien inférieur à celui des enzymes naturelles.
Pour obtenir ces nouveaux nanozymes, les chercheurs ont émis l’hypothèse que l’activité catalytique à l’origine de la vie aurait pu émerger comme le résultat de l’auto-assemblage de peptides courts et de faible complexité dans des structures similaires aux amyloïdes qui agissaient comme les enzymes ancestrales primitives. /P>
"Montrer que ces molécules ont une action catalytique sans avoir besoin d'une coordination conventionnelle basée sur l'histidine représente un changement significatif dans la façon dont nous comprenons l'origine de l'activité catalytique au début de la vie. Nous savons maintenant que cette activité peut être obtenue si les peptides ancestraux contiennent tyrosine. Par conséquent, nous suggérons qu'il est hautement probable que les enzymes ancestrales basées sur les amyloïdes utilisaient également ce deuxième acide aminé dans leurs réactions chimiques", conclut Ventura.
Dans l'étude, les chercheurs ont combiné expériences et simulations en utilisant diverses techniques telles que la spectrophotométrie, la fluorescence, la microscopie électronique, la diffraction électronique et la modélisation informatique avancée.
Plus d'informations : Susanna Navarro et al, Les fibrilles amyloïdes formées par de courts peptides inspirés des prions sont des métalloenzymes, ACS Nano (2023). DOI :10.1021/acsnano.3c04164
Informations sur le journal : ACS Nano
Fourni par l'Université autonome de Barcelone