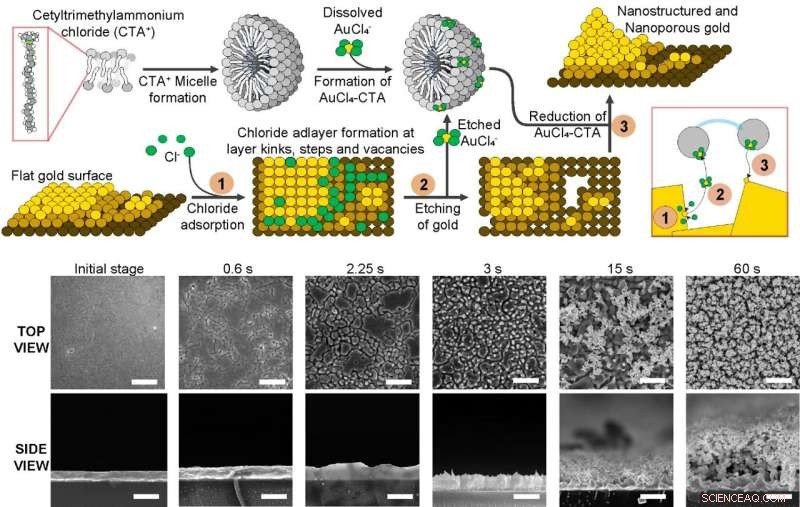
Mécanisme pour générer des surfaces d'or nanostructurées et nanoporeuses basées sur la gravure et le dépôt préférentiels du substrat à l'aide d'un tensioactif qui forme des micelles en solution, de chlorure de sodium et d'un sel d'or. En appliquant des impulsions électriques, le chlorure est d'abord adsorbé sur la surface, puis l'or est gravé mais capturé par les micelles de tensioactif. Enfin, il est redéposé sur le substrat faisant croître les nanostructures au cours du processus. En bas, des micrographies électroniques à balayage montrent la formation de nanostructures et de nanopores à la surface tout au long du processus. Crédit :Institut des sciences fondamentales
Les biomarqueurs sont des composants qui peuvent être présents dans des échantillons biologiques et sont liés à des maladies spécifiques. Par conséquent, les médecins peuvent analyser des échantillons biologiques d'un patient pour vérifier son état de santé ou pour suivre l'évolution d'un traitement spécifique. En règle générale, ces échantillons doivent être purifiés et dilués avant l'analyse, et les techniques de diagnostic médical actuelles reposent sur des établissements de soins de santé et des laboratoires pour ces analyses de routine. Il s'agit d'un long processus qui nécessite du personnel formé et des instruments coûteux pour extraire, transporter, stocker, traiter et analyser les échantillons dans des emplacements centralisés. De plus, en période de crise mondiale comme la pandémie en cours, la pression de milliers de demandes d'analyses peut saturer et effondrer le système de santé.
D'autre part, les dispositifs de point de service, qui sont de petits instruments automatisés, sont capables d'effectuer des diagnostics dans des endroits décentralisés et peuvent fournir des réponses rapides. Un exemple d'un tel appareil est le lecteur de glycémie que les personnes atteintes de diabète utilisent pour surveiller leur taux de sucre dans le sang. Ces appareils peuvent surmonter les limitations inhérentes au traitement d'un échantillon via un système centralisé, permettant à quiconque de surveiller sa santé depuis son domicile, en utilisant simplement un petit échantillon de sang extrait avec une piqûre au doigt.
Cependant, le développement de ces appareils a été entravé par les défis techniques liés à la mesure des échantillons biologiques. Les biomarqueurs de certaines maladies et infections ne sont présents dans les échantillons qu'en très petites quantités, ce qui impose à son tour le défi de développer des techniques de détection extrêmement sensibles. Alors que l'augmentation de la surface du biocapteur peut augmenter la sensibilité de l'instrument, ces surfaces ont tendance à être rapidement obstruées et contaminées, ce qui les rend inutilisables.
À cette fin, l'équipe dirigée par le professeur CHO, Yoon-Kyoung au Centre pour la matière molle et vivante au sein de l'Institut des sciences fondamentales (IBS) à Ulsan, en Corée du Sud, a récemment développé un biocapteur utilisant une méthode pour générer des surfaces nanostructurées et nanoporeuses. Cette stratégie combinée confère non seulement au capteur une sensibilité sans précédent, mais le rend également résistant à l'encrassement par les protéines.
Alors qu'il n'existait auparavant aucune méthode connue pour créer de manière fiable des électrodes à l'aide de tels substrats nanostructurés et nanoporeux, l'équipe a rapporté une méthode simple pour générer de tels matériaux. Le mécanisme est basé sur l'application d'impulsions électriques sur une surface plane en or en présence de chlorure de sodium et d'un tensioactif pouvant former des micelles en solution. Ces impulsions électriques entraînent une réaction préférentielle pour graver et redéposer l'or de la surface et, à leur tour, faire croître des nanostructures et former les nanopores. L'utilisation de tensioactif sous forme de micelles est essentielle au succès de cette stratégie puisqu'elle évite que le matériau qui est gravé ne se diffuse au cours du processus, afin qu'il puisse être redéposé.
La formation de ces nanostructures a donné une grande surface qui a été bénéfique pour augmenter la sensibilité des essais, alors que la formation de substrats nanopores était idéale pour empêcher la contamination des échantillons biologiques. Les avantages combinés des nanostructures et des nanopores ont été la clé du succès de cette stratégie, qui pourrait être appliquée à l'analyse directe d'échantillons de plasma cliniques.
Les chercheurs ont en outre démontré cette nouvelle technologie en construisant un biocapteur pour la détection du cancer de la prostate. L'électrode était suffisamment sensible pour faire la distinction entre un groupe de cancers de la prostate et des donneurs sains en utilisant seulement une infime quantité d'échantillons de plasma sanguin ou d'urine. Aucune étape de dilution ou de prétraitement n'a été utilisée, ce qui signifie que la technologie pourrait facilement être utilisée pour le diagnostic du cancer au point de service.
Le professeur Cho a déclaré que "nous pensons que cette technologie est essentielle pour le développement futur d'appareils de point de service et de tests de diagnostic qui fonctionnent avec des échantillons biologiques. La capacité de détecter de faibles concentrations de biomarqueurs pertinents avec des performances robustes ouvre la porte à des possibilités dans le domaine du diagnostic du cancer, des agents pathogènes et d'autres maladies."
Les résultats de cette recherche ont été publiés dans Advanced Materials le 17 mai 2022 et l'illustration associée a été sélectionnée pour le frontispice du numéro actuel. Accélérer la détection des biomarqueurs du cancer pour les diagnostics au point de service