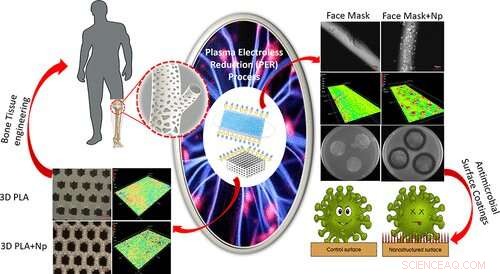
Résumé graphique. Crédit :Matériaux appliqués et interfaces ACS (2022). DOI :10.1021/acsami.2c01195
Une équipe interdisciplinaire de chercheurs de l'Université de l'Alabama à Birmingham a mis au point un nouveau procédé activé par le plasma qui pourrait limiter la prolifération des toxines des implants dans la circulation sanguine d'un patient. L'équipe, dirigée par Vinoy Thomas, Ph.D., professeur agrégé au département de génie mécanique et des matériaux de l'UAB School of Engineering, a récemment publié des résultats dans l'ACS Applied Materials &Interfaces journal.
Dans l'article, les auteurs expliquent qu'un défi majeur du développement d'un matériau d'implant biomédical modifié par des nanoparticules est de fixer de manière stable des nanoparticules métalliques sur différentes surfaces, en particulier les surfaces polymères.
"Pendant des années, les scientifiques ont réalisé la synthèse de nanoparticules métalliques dans des solutions aqueuses en utilisant des agents réducteurs chimiques et biologiques (extraits de plantes)", a déclaré Thomas. "Le défi de fixer des nanoparticules métalliques est particulièrement difficile dans les cas impliquant des biomatériaux polymères hydrophobes, dont relèvent la plupart des biomatériaux polymères."
Pour relever ce défi, Thomas et son équipe ont développé un processus activé par plasma appelé réduction autocatalytique au plasma. Le processus PER permet aux chercheurs de déposer des nanostructures d'or et d'argent sur différentes surfaces de matériaux polymères 2D et 3D, telles que du papier de cellulose, des masques à base de polypropylène et des échafaudages polymères imprimés en 3D.
"Il est bien connu qu'il existe des problèmes de toxicité liés à la libération rapide et prématurée des nanostructures métalliques du matériau de l'implant dans la circulation sanguine", a déclaré Thomas. "Ce problème ne pourrait être résolu qu'en assurant l'ancrage stable des nanostructures métalliques sur les surfaces des implants. Cela nous a inspirés pour optimiser notre processus PER en menant une enquête systématique et approfondie de la concentration du précurseur métallique suivie d'un lavage par sonication avant la culture cellulaire in vitro."
Dans l'étude de Thomas, son équipe a pu ancrer avec succès des nanoparticules d'argent à la surface de polymères imprimés en 3D sans aucune libération rapide dans l'environnement. L'expertise de l'équipe en matière de fabrication additive leur a également permis de concevoir des tranches d'échafaudage 3D plus petites qui s'intégreront dans le puits d'une plaque à 96 puits.
"Nous prévoyons que la conception d'un tel échafaudage 3D plus petit et cohérent garantirait des tests in vitro à grande échelle et plus fiables des échafaudages 3D", a déclaré Thomas. "Cette optimisation systématique de la fabrication de nanostructures métalliques uniformes sur des échafaudages 3D avec une cytocompatibilité et des propriétés antibactériennes potentielles sera très pertinente et peut potentiellement avoir un impact sur le développement futur d'échafaudages biocompatibles, en particulier pour la maladie de l'ostéomyélite."
Il a fallu deux ans à l'équipe pour développer le procédé PER, mais ce procédé n'est qu'un des nombreux aspects que Thomas étudie en ce qui concerne le plasma.
"Le plasma, le quatrième état de la matière, est un gaz partiellement ionisé qui représente l'une des méthodes les plus vertes de synthèse de nanoparticules métalliques en phase liquide", a-t-il déclaré. "Il a une énorme capacité de traitement des matériaux et de décontamination des surfaces pour prévenir la propagation du COVID-19 et d'autres maladies transmissibles." Développement d'électronique imprimée ultra-haute résolution utilisant l'architecture à double surface