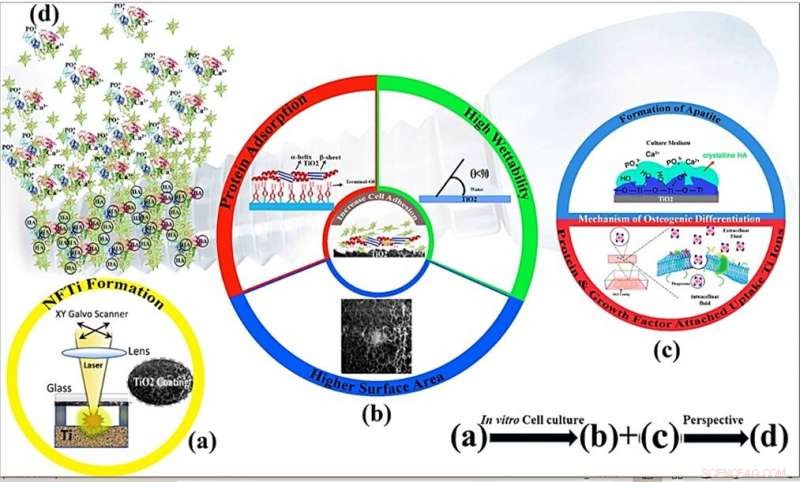
Mécanismes schématiques de la prolifération cellulaire et de l'ostéoinductivité d'un revêtement en titane nanofibreux par modification de surface par transfert inverse induit par laser à haute intensité (HILIRT) :une nouvelle méthode de dépôt. (a) Couche NFTi déposée sur verre par la technique HILIRT proposée à des vitesses de balayage du faisceau laser. (b) La biocompatibilité du titane en tant que matériau d'implant est attribuée à l'oxyde de surface se formant spontanément dans l'air et/ou les fluides physiologiques, et on pense que les comportements cellulaires, par exemple., adhésion, la propagation et la prolifération sont grandement affectées par 1. la surface 2. la mouillabilité 3. les groupes hydroxyles de surface (les groupes hydroxyles de surface de l'OH terminal régulent les comportements d'adsorption des protéines initiales). (c) Les groupes hydroxyles de surface et les nanoparticules de Ti bioactives favorisent la différenciation des ostéoblastes à travers 1. Les groupes Ti-OH formés à la surface du titanate après trempage dans un milieu de culture ostéogénique sont chargés négativement, et donc se combinent sélectivement avec les ions Ca2+ chargés positivement dans le fluide pour finalement former du phosphate de calcium. 2. Biocomplexes (ions, protéine et facteur de croissance) sont internalisés par endocytose médiée par les cavéoles. (d) Perspective :Formation et remodelage osseux autour des matériaux implantés. Crédit :Rapports scientifiques, doi:10.1038/s41598-019-54533-z
Dans une nouvelle étude publiée le Rapports scientifiques , Mohammad-Hossein Beigi et une équipe de recherche des départements d'ingénierie et de sciences appliquées et de biotechnologie cellulaire au Canada et en Iran ont décrit une nouvelle méthode pour former des biomatériaux biocompatibles pour l'ingénierie des tissus osseux. Ils ont conçu comme le Web, revêtements nanofibreux tridimensionnels (3D) de Titania utilisant un transfert inverse induit par laser à haute intensité (HILIRT). L'équipe a d'abord démontré le mécanisme d'ablation et de dépôt de titane (Ti) sur des substrats de verre en utilisant plusieurs impulsions laser picosecondes dans l'air ambiant pour comparer les prédictions théoriques avec les résultats expérimentaux. Ils ont examiné les performances d'échantillons de verre développés en enduisant des structures nanofibreuses d'oxyde de titane à travers des durées d'impulsion laser variées, en utilisant des méthodes telles que la microscopie électronique à balayage (MEB).
Pour comprendre les interactions entre la surface du nouveau matériau et les cellules biologiques, Beigi et al. ont exploré les interactions des cellules souches mésenchymateuses dérivées des os humains (BMSC) cultivées sur les nouveaux biomatériaux. Pour ça, ils ont utilisé une variété de tests en laboratoire, y compris une méthode colorimétrique pour comprendre l'activité métabolique des cellules (test MTS), immunocytochimie, analyses d'adsorption et d'absorption des protéines. Les résultats ont montré une biocompatibilité significativement améliorée dans les échantillons traités au laser par rapport aux substrats non traités. Beigi et al. modifié leur technique HILIRT en diminuant la durée d'impulsion et en générant des nanofibres d'oxyde de titane avec des structures plus denses au cours de l'ingénierie des matériaux avancés. D'après leurs conclusions, la densité des nanostructures et la concentration des nanofibres enrobées ont joué un rôle essentiel pour générer une bioactivité dans les échantillons traités en induisant une différenciation précoce des BMSC (cellules souches mésenchymateuses dérivées d'os) pour former du tissu osseux via une différenciation ostéogénique (formation osseuse).
Les bioingénieurs développent rapidement de nouvelles techniques d'ingénierie des tissus osseux (BTE) pour la régénération osseuse; améliorer les « gold standards » existants des méthodes d'autogreffe et d'allogreffe osseuses en médecine régénérative. Les inconvénients des techniques existantes comprennent la morbidité du site donneur et les suppléments nutritionnels limités pendant la régénération osseuse. L'ingénierie tissulaire osseuse (BTE) est une direction de recherche prometteuse pour faciliter la croissance et la réparation osseuses, même dans les défauts squelettiques à grande échelle. Les chercheurs visent à utiliser des cellules souches avec BTE en raison de leurs capacités d'auto-renouvellement parallèlement à la différenciation des cellules souches, pour former une variété de types de tissus. Étant donné que les propriétés physiques et chimiques de la surface d'un matériau peuvent influencer la viabilité des cellules souches mésenchymateuses humaines (hMSC) pour l'auto-restauration, différenciation et prolifération. Les matériaux et les cellules peuvent donc travailler ensemble dans les applications de BTE pour fournir une plate-forme souhaitée pour l'ostéointégration pendant le remodelage osseux.
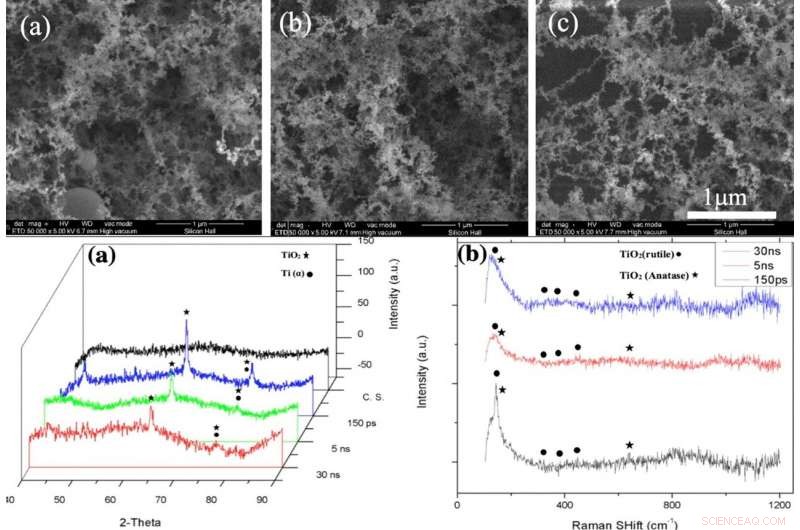
EN HAUT :images SEM de la couche NFTi (Nanofibrous Titania) avec une puissance = 10 W, fréquence = 600 KHz (a) durée d'impulsion = 150 ps, (b) durée d'impulsion = 5 ns, (c) durée d'impulsion = 30 ns avec un grossissement de 50000X. EN BAS :(a) modèle XRD, (b) Spectre Raman de verre nu et d'échantillons recouverts d'oxyde de titane avec différentes durées d'impulsion (créé par Origin Pro 2019B (GF3S4-3089-7907079) https://www.originlab.com/). Crédit :Rapports scientifiques, doi:10.1038/s41598-019-54533-z.
Les équipes de recherche avaient auparavant utilisé plusieurs techniques pour produire des surfaces de matériaux BTE, notamment le sol-gel, hydrothermale 106, électrofilage et impression 3D; cependant, choisir une méthode idéale reste un défi. Par exemple, les biomatériaux artificiels doivent interagir sans effort avec les fluides physiologiques et s'assimiler aux tissus environnants durs et mous pour maintenir l'activité cellulaire pour une biocompatibilité supérieure. Les scientifiques des matériaux et les bio-ingénieurs avaient utilisé le titane et ses alliages pour les implants orthopédiques, permettant l'ostéogenèse à base de nanoparticules de titane (NP) des cellules souches de la pulpe dentaire et des cellules souches dérivées du tissu adipeux. Les méthodes de modification de surface au laser peuvent modifier les surfaces des matériaux pour une biocompatibilité de surface améliorée ; où la méthode HILIRT avait déjà montré son potentiel pour concevoir des composants de laboratoire sur puce et d'autres biomatériaux biocompatibles. Les scientifiques peuvent modifier les paramètres laser pour manipuler les surfaces des matériaux afin d'aider la différenciation cellulaire.
Dans le travail present, Beigi et al. étudié les effets de la durée d'impulsion laser sur les surfaces des matériaux à l'aide de la méthode HILIRT et testé le comportement biologique des biomatériaux synthétiques en utilisant la caractérisation des matériaux et des tests biologiques en laboratoire. Ils ont étudié le contact cellule-matériau sur des surfaces matérielles en utilisant l'expression génique, études de minéralisation et d'interaction protéique. Les scientifiques ont développé un film mince d'oxyde de titane nanofibreux (NFTi) et l'ont trempé dans un fluide corporel simulé (SBF) pour former des structures de couche de type hydroxyapatite (HA) et ont identifié les modifications de la surface du matériau à l'aide de l'angle de contact avec l'eau (CA), microscopie électronique à balayage (MEB), analyse par spectroscopie de rayons X à dispersion d'énergie (EDS), spectroscopies de micro-Raman et de diffraction des rayons X (XRD).
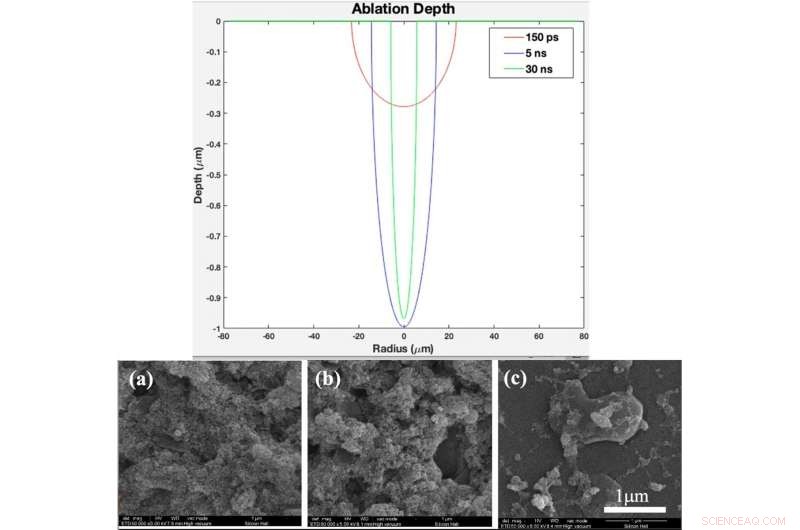
TOP :Profil de profondeur d'ablation théorique en fonction du rayon pour une durée d'impulsion de 150 ps, 5 ns, et 30 ns (créé dans le logiciel MATLAB R2015b (9.6.0.1072779) https://www.mathworks.com). EN BAS :(a) modèle XRD, (b) Spectre Raman de verre nu et d'échantillons recouverts d'oxyde de titane avec différentes durées d'impulsion après 2 jours d'immersion dans le SBF, (c) modèle XRD, (d) Raman spectrum of bare glass and samples coated by titania with different pulse duration after 4 days immersion in SBF Fig. 4. (a). XRD pattern, (b) Raman spectrum of bare glass and samples coated by titania with different pulse durations (created by Origin Pro 2019B (GF3S4-3089-7907079) https://www.originlab.com/). Crédit :Rapports scientifiques, doi:10.1038/s41598-019-54533-z.
They deposited NFTi (nanofibrous titania) structures at different pulse durations to form laser nanofiber coated smooth surfaces and tested the chemical and physical composition of the resulting advanced materials. When they decreased pulse duration, the titanium weight percentage increased, and the scientists observed the temperature of the irradiated zone to be significantly higher for a shorter pulse duration of 150 picoseconds (ps) compared with 5 nanoseconds (ns) and 30 ns. The decreased pulse duration transmitted power to the target in a shorter time, causing the heat affected zone (HAZ) to have a higher temperature, allowing a denser plasma plume to form more NFTi structures on a glass substrate. Decreasing the laser pulse duration created more biocompatible Ti nanofibers with a higher content of HA(hydroxyapatite)-like substance sedimentation on the samples.
Using phase-contrast microscopy images of fibroblast-like BMSCs on titania-coated glass surfaces, Beigi et al. observed normal cell morphology. They measured water contact angles of droplets of water on the material specimens and conducted cytotoxicity tests with MTS assays on stem cells grown on NFTi coatings. The materials coated with NFTi for 150 ps showed the highest absorbance rate (known as the S1 group) with subsequently high rates of cell viability, cell adhesion and metabolic activity. When the researchers used immunofluorescent staining to observe cell migration, the S1 sample (with NFTi coating for 150 ps) showed higher rates of cell migration. To confirm stem cell (BMSC) differentiation, the scientists investigated osteogenic-related gene expression with RUNX2, collagen I, osteopontin and osteonectin genes, using quantitative qRT-PCR. Parmi les échantillons, S1 samples indicated significantly higher relative expression for all osteogenic-related genes.
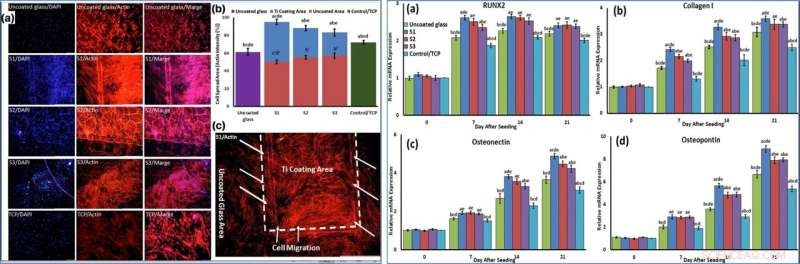
LEFT:Cells were stained by phalloidin to observe (a, c) and quantify (b) actin filament expansion and migration in all samples after 7 days. The first column in A is DAPI nuclear staining (blue), second column, phalloidin labelled F-actin (red), and third column, overlaid fluorescent image of immunostained cellular components (merge:DAPI/F-actin). The red bars in B indicate the intensity percentage of actin filament on the glass in S1, S2, and S3 samples and the blue bars describe the intensity percentage of actin filament the NFTi coated area. (c) Higher magnification of BMSCs migration from glass area toward Ti coating area in S1. RIGHT:The mRNA relative expression levels of osteogenic genes included Runx2 (a), Collagen I (b), Osteonectin (c), and Osteopontin (d) determined by qRT-PCR for all samples. Crédit :Rapports scientifiques, doi:10.1038/s41598-019-54533-z.
To confirm mineralization, the scientists used alizarin red followed by soluble Ca nodules color absorbance quantification, to observe high levels of mineralization on all samples on days seven and 14. The team investigated surface protein absorption potential, protein-ion biocomplex formation and biocomplex cell uptake to demonstrate highest levels of protein-ion biocomplex formation on the S1 samples.
De cette façon, Mohammad-Hossein Beigi and colleagues used the HILIRT method to achieve high surface bioreactivity, osteogenesis and osseointregration of NFTi-BMSCs. The surface character of the new materials allowed protein and biomolecule interactions to stimulate cell adhesion, mineralization and osteogenesis for faster and more suited osseointegration in vivo and in vitro. The scientists engineered nanofiber mesh-like scaffolds using titanate to allow vascularization, protein attachment, cell proliferation and cell attachment on the substrate. Such microporous surfaces can promote nutrition diffusion, vascularization and blood flow due to improved biomechanical strength. En outre, the hydrophilic surface property; verified using water contact angle measurements, facilitated cell-ECM adhesion to improve cell binding and vigorous tissue growth.
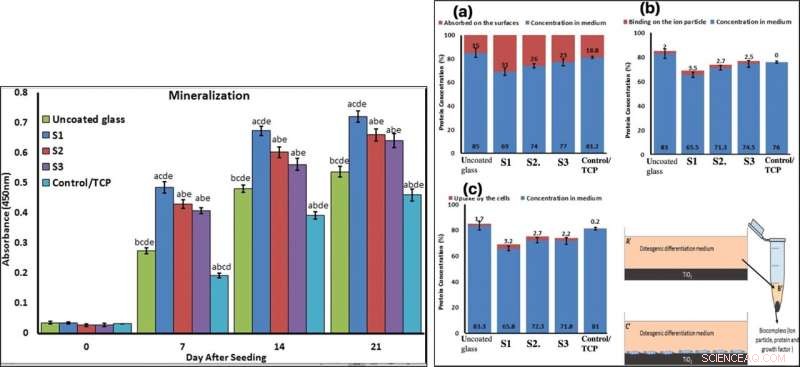
LEFT:Confirmation of osteogenic differentiation and matrix mineralization of BMSCs by quantifying alizarin red staining. RIGHT:Protein adsorption and biocomplex adsorption/absorption:concentration of protein in osteogenic differentiation medium after 6 hours of immersion (a); concentration of protein in osteogenic differentiation medium after 6 hours of immersion and then centrifuged at 14, 000 rpm for 30 min (b); concentration of protein in osteogenic differentiation medium after 6 hours of immersion with cell culture (c). Crédit :Rapports scientifiques, doi:10.1038/s41598-019-54533-z.
The S1 sample (NFTi, 150 ps) developed in this work generated the best surface bioreactivity for bone regeneration or bone replacement. Beigi et al. showed the advantages of using titania as an orthopedic implant material and the surface modification strategies implemented in the study improved surface bioreactivity and osteogenesis for assisted bone tissue development. The cost-effective frugal method can provide a metallic nanofiber structure surface to be coated on multiple surfaces for varied biomedical applications. The proposed technique (combining materials engineering with stem cells) will open new doors to engineer advanced biomaterials with enhanced surface bioreactivity for improved biocompatibility in vitro and in vivo. The findings demonstrate beneficial effects of an experimental scaffold in the lab with potential for medical osseointegration as a BTE implant.
© 2019 Réseau Science X