
a) Microstructure des échafaudages de collagène chargés de cellules examinées sous MET. Les cellules sont entourées par la matrice de collagène. Les fibrilles de collagène n'ont montré aucune direction préférée autour des cellules dans des conditions de contrôle, b) Les IONP peuvent être identifiées dans la matrice de collagène et c) à proximité des membranes cellulaires. Après 14 jours, une nouvelle matrice a été synthétisée par les cellules, d) sans SMF et e) avec SMF. Les deux conditions ont conduit à une nouvelle synthèse de matrice après 14 jours, sans différence significative. Crédit: Rapports scientifiques , doi:10.1038/s41598-018-33455-2.
Les mécanismes cellulaires et moléculaires de la régénération osseuse par stimulation magnétique nécessitent actuellement une meilleure compréhension. Pour évaluer le phénomène en laboratoire, un modèle de collagène natif tridimensionnel (3-D) a été récemment développé par compression plastique pour produire une cellule, structure de collagène dense et mécaniquement résistante. Pour produire des modèles chargés de cellules dans l'étude, Zhiyu Yuan et ses collègues ont incorporé des cellules ostéoblastiques (lignée cellulaire MG-63) et des nanoparticules d'oxyde de fer magnétique (IONP) dans les gels de collagène. Grâce à l'impression 3D, un bioréacteur magnétique a été conçu et fabriqué pour soutenir la croissance cellulaire sous des champs magnétiques statiques (SMF). En utilisant la réaction en chaîne par polymérase (PCR), les chercheurs ont déterminé l'impact des SMF sur la régulation et l'expression des gènes liés à l'ostéogenèse, y compris le facteur de transcription 2 lié à l'avorton (Runx2), l'ostéonectine (ON) et les protéines morphogénétiques osseuses 2 et 4 (BMP-2 et BMP-4).
Maintenant publié dans Rapports scientifiques , les résultats ont démontré que les SMF, Les IONP et la matrice de collagène ont pu stimuler la prolifération, production de phosphatase alcaline et minéralisation des ostéoblastes. Le processus a été activé en influençant les interactions matrice-cellule pour influencer l'expression de Runx2, AU, BMP-2 et BMP-4. Le modèle de collagène a permis de former progressivement un nouveau modèle osseux minéralisé en 3D et de comprendre la stimulation magnétique sur l'ostéogenèse. Des études supplémentaires peuvent être menées avec le modèle pour des applications en ingénierie tissulaire et en médecine régénérative.
Au Royaume-Uni seulement, le nombre de patients souffrant de fractures osseuses a un impact économique substantiel sur la qualité de vie, comme en témoignent les coûts pour le National Health Services (NHS). Lors d'une lésion osseuse, le processus biologique et mécanique de régénération physiologique remplace l'os blessé par un nouvel os sur le site de la blessure. Le processus métabolique est compliqué et nécessite l'interaction de nombreux facteurs, y compris les facteurs de croissance et de différenciation tels que les hormones, cytokines et composants extracellulaires; pendant ce temps, des facteurs inadéquats ou interrompus peuvent entraîner un retard de cicatrisation ou une altération/une non-consolidation de l'os.
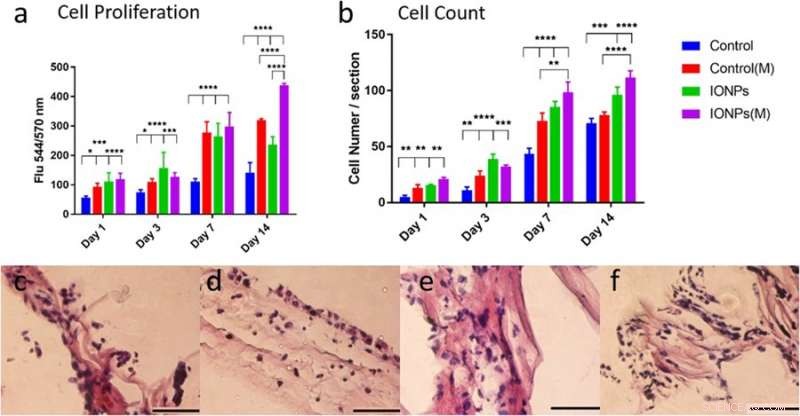
a) comparaison de la prolifération des cellules MG-63 lorsqu'elles sont cultivées avec/sans incorporation d'IONP avec exposition de SMF (M) et sans exposition de SMF. La prolifération cellulaire peut être améliorée avec les SMF en incorporant des IONP, indiquant un effet stimulant, b) Comparaison des nombres cellulaires des lignées cellulaires MG-63 à partir d'images histologiques avec ou sans SMF. Les réponses cellulaires de la lignée cellulaire MG-63 cultivée sur échafaudage de collagène PC ont également été examinées par histologie pour les conditions c) sans SMF et sans IONP, d) avec les SMF, e) avec des IONP et e) combinant des SMF et des IONP. Crédit: Rapports scientifiques , doi:10.1038/s41598-018-33455-2.
Dans l'étude, les auteurs ont utilisé un roman, modèle de collagène 3-D biomimétique multifonctionnel à utiliser comme plate-forme in vitro pour étudier les mécanismes de stimulation magnétique sur l'ostéogenèse. Pour produire une gamme de modèles chargés de cellules, les chercheurs ont introduit des stimuli internes (nanoparticules d'oxyde de fer) et externes (champs magnétiques statiques, SMFs) dans le système. Le matériau biomimétique a été conçu via la fabrication de nano- et microstructures utilisant la compression plastique, selon un protocole préalablement établi. Afin d'évaluer les comportements biologiques des ostéoblastes, y compris leur prolifération, différenciation, minéralisation, analyse de l'expression des gènes et de la microstructure, les scientifiques ont cultivé le modèle de collagène dans un bioréacteur magnétique jusqu'à 42 jours.
Dans l'étude, la prolifération cellulaire de la lignée cellulaire ostéoblastique MG-63 a été évaluée en utilisant le test alamarBlue. Au jour 14, les chercheurs ont observé une différence significative entre les SMF seuls, Les IONP seuls et en combinaison sur la prolifération cellulaire. Des techniques d'histologie ont été utilisées pour examiner les réponses cellulaires dans les échafaudages de collagène et comprendre le rôle des SMF et des IONP sur la prolifération cellulaire. La visualisation a été suivie d'une analyse quantitative du nombre de cellules, les résultats ont indiqué que l'incorporation des IONP prolongeait l'effet des SMF.
De la même manière, la différenciation cellulaire a été observée avec les activités de la phosphatase alcaline (ALP) pour les échafaudages de collagène, avec ou sans incorporation d'IONP. Comme avant, lorsque l'effet des IONP et des SMF était combiné, la production d'ALP était significativement stimulée par rapport au traitement avec les SMF seuls et les IONP seuls. La minéralisation cellulaire a également été observée par la suite et quantifiée dans l'échafaudage de collagène ensemencé de cellules. Après 42 jours, tous les échantillons ont été colorés avec une coloration ARS pour indiquer une minéralisation complète. En revanche, la combinaison des SMF et des IONP n'a pas pu favoriser la minéralisation.
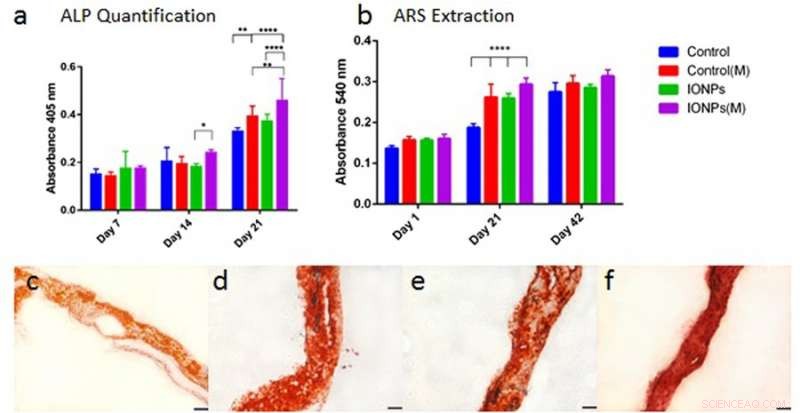
a) comparer la production d'ALP de la lignée cellulaire MG-63 lorsqu'elle est cultivée dans des échafaudages de collagène avec ou sans incorporation d'IONP, avec exposition aux SMF (M) et sans exposition aux SMF. b) Comparer la minéralisation cellulaire en extrayant et en quantifiant la coloration de l'ARS à partir d'échafaudages traités avec ou sans exposition aux SMF. Des échafaudages de collagène chargés de cellules ont été intégrés aux IONP (100 µg/ml) les résultats ont été collectés sur 1, 21 et 42 jours de culture. c) Coloration ARS de l'échafaudage de collagène en l'absence de SMF et IONP, d) avec les SMF, e) avec les IONP, et f) avec les SMF et les IONP. Crédit: Rapports scientifiques , doi:10.1038/s41598-018-33455-2.
Après, les scientifiques ont mené des études pour comprendre les réponses des échafaudages de collagène ensemencés de cellules aux SMF et aux IONP au niveau moléculaire. Pour ça, les niveaux d'expression de Runx2, AU, BMP-2 et BMP-4 ont été quantifiés à l'aide d'une amplification en chaîne par polymérase quantitative en temps réel (RT-qPCR). Un traitement de 7 jours de SMF seuls n'a pas eu d'effet sur l'expression de Runx2, alors qu'une expression accrue a été trouvée lorsque les SMF ont été combinés avec des IONP, démontrant l'expression de Runx2 médiée par la matrice de collagène au cours de l'ostéogenèse. Au jour 7 le niveau d'expression de ON dans les échantillons traités avec les IONP, Les SMF et les deux étaient plus élevés que dans le contrôle dans un court laps de temps. Lors de l'expression de BMP-2 et BMP-4, des résultats similaires ont été observés sur 7 à 14 jours.
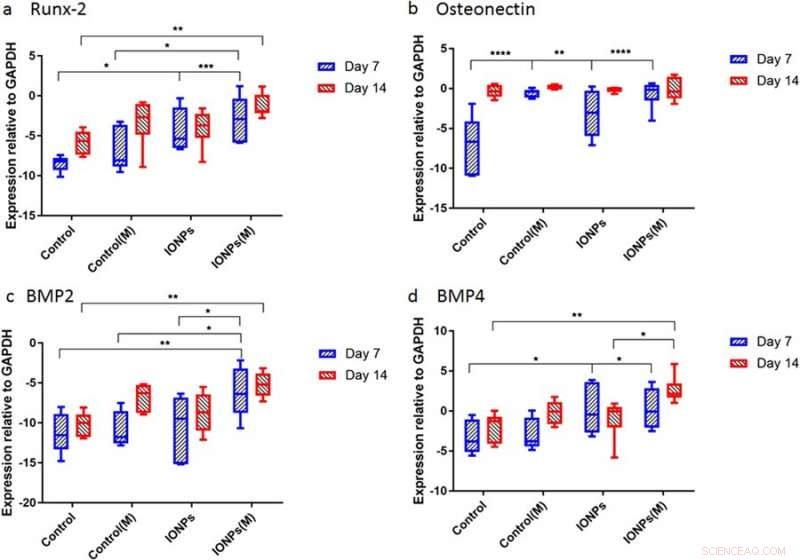
Expression génique pour a) Runx2, b) l'ostéonectine (ON), c) BMP-2 et d) BMP-4 normalisée avec le contrôle GAPDH après 7 et 14 jours de culture cellulaire. Crédit: Rapports scientifiques , doi:10.1038/s41598-018-33455-2.
L'étude a principalement démontré l'ostéogenèse comme un processus complexe médié par l'activation et l'expression successives de plusieurs gènes clés, y compris Runx2, AU, BMP-2 et BMP-4. Typiquement, Runx2 régule positivement l'expression des gènes protéiques liés à la matrice osseuse pour favoriser la formation osseuse in vitro et in vivo. Par conséquent, l'étude a montré que l'exposition au SMF peut induire la prolifération de la lignée cellulaire en modulant l'expression précoce de Runx2, pour accélérer l'ostéogenèse. Lorsque les IONP ont été constituées en SMF, l'expression du gène de l'ostéonectine (ON) a augmenté, reliant les phases de collagène avec le minéral osseux pour initier une minéralisation normale du tissu squelettique. De la même manière, BMP-2 et BMP-4 n'ont augmenté que dans l'étude lors d'une culture cellulaire combinée avec des SMF et des IONP.
De cette façon, les auteurs ont développé et testé un modèle de collagène biomimétique 3-D qui pourrait progressivement se minéraliser pour former par la suite un nouveau modèle osseux in vitro. Le modèle a été incorporé avec des cellules ostéoblastiques et des nanoparticules capables de répondre à des stimulations magnétiques externes. Le modèle de collagène biomimétique a été conçu par compression plastique pour intégrer la lignée cellulaire MG-63 et démontrer des résultats reproductibles et cohérents combinés avec les SMF et les IONP. Les interactions cellule-matrice ont réussi à réguler à la hausse l'expression de gènes clés liés à l'ostéogenèse. Les auteurs ont l'intention de développer davantage le modèle 3-D pour servir de plate-forme supérieure pour étudier les comportements biologiques in vitro avec des applications potentielles en génie tissulaire et en médecine régénérative.
© 2018 Réseau Science X