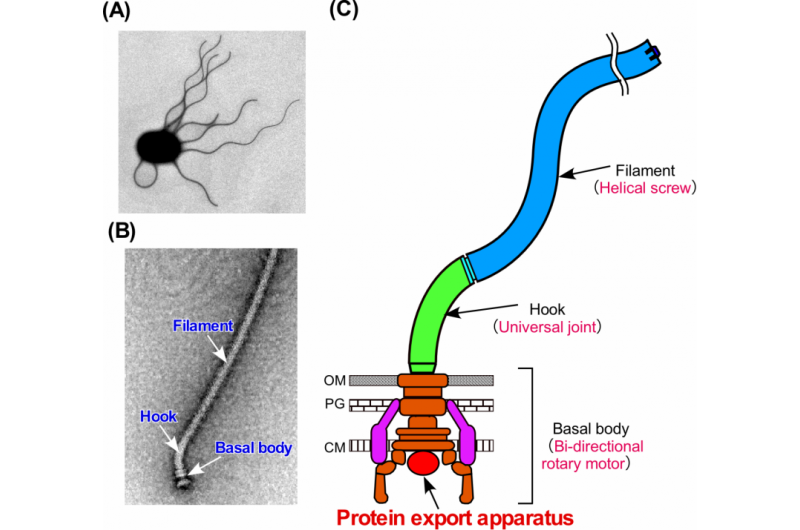
Figure 1. Le flagelle bactérien. (A) Micrographie électronique d'une cellule de Salmonella. (B) Micrographie électronique du flagelle de Salmonella. (C) Schéma de principe du flagelle. Le flagelle se compose d'au moins trois parties :le corps basal en tant que moteur rotatif bidirectionnel, le crochet comme joint universel et le filament comme vis hélicoïdale. Crédit :Université d'Osaka
Les chercheurs de l'Université d'Osaka utilisent la cristallographie aux rayons X et la microscopie électronique pour résoudre l'assemblage de l'appareil de porte d'exportation à Salmonella. Les nouveaux détails de cette nanomachine devraient clarifier comment les bactéries infectent les cellules eucaryotes et présenter de nouvelles cibles moléculaires pour la découverte de médicaments.
L'une des plus anciennes nanomachines en biologie est le flagelle bactérien. Cet appareil est évolutif essentiel, conférant aux bactéries la capacité de se déplacer. Le flagelle partage une grande similitude avec une autre structure bactérienne, l'injectable, qui, comme son nom l'indique, est la façon dont certaines bactéries livrent leur contenu pour infecter un hôte. Une nouvelle étude menée par des chercheurs de l'Université d'Osaka révèle comment une structure spécifique dans le flagelle et l'injectisome, le complexe de la porte d'exportation, s'assemble dynamiquement et comment empêcher cet assemblage pourrait rendre les bactéries inoffensives. L'étude peut être vue dans PLOS Biologie .
Le professeur agrégé Tohru Minamino de la Graduate School of Frontier Biosciences étudie depuis de nombreuses années le complexe de portes d'exportation à l'aide de la microscopie électronique. Son intérêt pour ce complexe est principalement dans l'ingénierie de nouvelles nanomachines, mais il a réalisé que la même recherche pourrait avoir des implications médicales.
"Il existe de nombreuses similitudes structurelles et fonctionnelles entre les protéines flagellaires et injectisome. Elles pourraient constituer de bonnes cibles pour inhiber l'infection bactérienne, " il a dit.

Figure 2. Modèle pour la structure en anneau FliP. FliP forme un homo-hexamère. Le complexe FliO agit comme un échafaudage pour se lier à FliP afin de faciliter la formation du cycle FliP. Crédit :Université d'Osaka
Le complexe d'exportation de Salmonella flagellum est constitué de cinq protéines transmembranaires. Ceux-ci s'assembleront séquentiellement pour former la porte d'exportation, en commençant par la protéine FliP. On pense que la porte d'exportation de l'injectisome de Salmonella s'assemble de la même manière en utilisant cinq protéines homologues. Minamino montre que même s'il ne fait pas partie de la structure de la porte, une sixième protéine transmembranaire, FliO, est essentiel pour commencer l'assemblage de la porte.
"FliO agit comme un échafaudage pour que FliP forme une structure en anneau. Sans cet anneau, les autres protéines transmembranaires ne suivront pas dans le complexe de porte, " il a dit.
Les images de microscopie électronique ont indiqué que l'échafaudage FliO provoque la formation d'un hexamère par FliP, ce qui permet aux protéines transmembranaires suivantes de se joindre à l'assemblage. Les calculs électrostatiques ont identifié quels acides aminés spécifiques dans FliP étaient critiques pour les interactions FliO-FliP et les interactions FliP-FliP, fournir des cibles candidates pour des médicaments expérimentaux. Pour démontrer que FliO est nécessaire à l'assemblage de la porte d'exportation et non à la structure, Minamino a montré que la surexpression de FliP peut contourner le défaut FliO et procéder à l'achèvement de l'appareil de porte d'exportation.
Bien que FliO permette à FliP de former un hexamère, la protéine homologue FliP dans l'injectisome, SpaP, forme un pentmère et un hétéro-hexamère avec SpaR, la protéine homologue FliR. L'analyse informatique a suggéré que FliP pourrait également prendre cette structure.
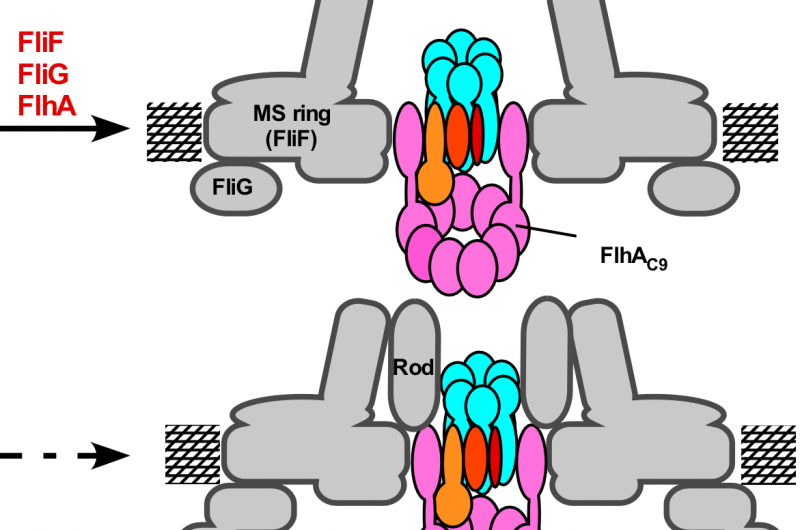
Figure 3. Modèle pour le processus d'assemblage de l'appareil d'exportation flagellaire. L'assemblage du complexe porte d'exportation commence par la formation de l'anneau FliP à l'aide du complexe FliO, suivi de l'assemblage de FliQ, FliR, et FlhB et enfin de FlhA lors de la formation d'anneaux MS dans la membrane cytoplasmique. À la fin de la structure en anneau C, le complexe cyclique ATPase cytoplasmique est formé à la base flagellaire, permettant aux substrats d'exportation d'entrer dans la cavité centrale du complexe annulaire FliP. Crédit :Université d'Osaka
"Un nombre important de particules annulaires FliP que nous avons analysées pourraient être affectées à une analyse rotationnelle de 5 fois, afin qu'ils puissent former des pentamères. Nous sommes convaincus que FliP est un bon modèle pour SpaP, " dit Minamino.
Identification de la première étape pour l'assemblage de la porte d'exportation, à savoir l'oligmérisation de FliP via les interactions FliO, suggère un moyen potentiel de perturber la pathologie des bactéries comme Salmonella.
"Nos résultats suggèrent que les homologues FliP de l'injectisome sont des cibles médicamenteuses prometteuses, " dit Minamino.