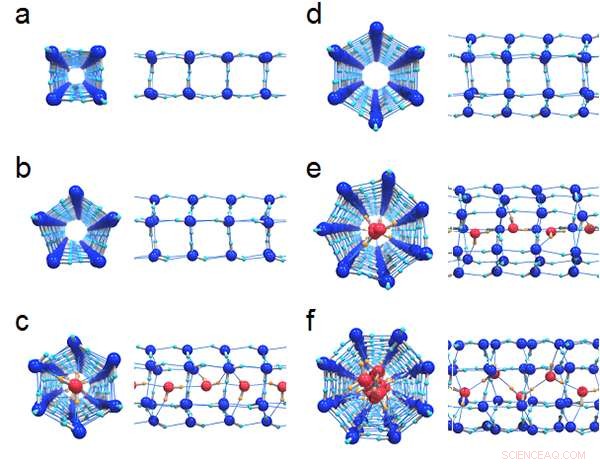
Figure 1 :Structures de liaison hydrogène de six glaces formées dans les nanotubes :(a) (4, 0) glace, (b) (5, 0) glace et (c) rempli (6, 0) glace à un diamètre de 1,11 nm, (d) (6, 0) glace, (e) rempli (7, 0) glace et (f) rempli (8, 0) de la glace à un diamètre de 1,25 nm. Les vues de dessus et la vue de côté correspondante sont dessinées de front. Les molécules d'eau centrales formant une chaîne dans les glaces remplies sont colorées en rouge pour les distinguer des anneaux extérieurs.
De nombreux physiciens n'acceptent pas l'idée qu'une limite de phase solide-liquide puisse se terminer à un point critique, un état unique où deux phases perdent leur identité distincte. Pourquoi ne le font-ils pas ? Le manuel faisant autorité de Landau et Lifshitz dit que "nous pouvons seulement dire qu'une propriété de symétrie particulière existe ou n'existe pas ; ... Le point critique ne peut donc pas exister pour de telles phases." Mais depuis 2001, la possibilité du point critique solide-liquide a été signalée dans des études de simulation informatique de l'eau dans les nanopores. En réalité, il n'y a pas de preuve rigoureuse de l'inexistence du point critique solide-liquide.
Kenji Mochizuki et Kenichiro Koga de l'Université d'Okayama ont fourni des preuves sans ambiguïté pour soutenir le point critique solide-liquide pour une classe d'eau dans les nanotubes en effectuant des simulations de dynamique moléculaire approfondies :séparation macroscopique des phases solide-liquide en dessous d'une température critique Tc, des capacités thermiques divergentes et une compressibilité isotherme aux alentours de Tc, et les loci des maxima de la fonction de réponse (les lignes Widom) au-dessus de Tc.
La figure 1 montre les structures de liaison hydrogène de six cristaux de glace formés dans des nanotubes de carbone avec des diamètres de 1,11 nm et 1,25 nm. Les chercheurs ont découvert que toutes les limites de phase de premier ordre entre la glace et le liquide ont finalement cessé d'exister aux points critiques, comme le montre la figure 2. Le diagramme de phase T-P est très différent de celui de l'eau en vrac, où les régions de glace sont complètement entourées par les limites de phase du premier ordre (lignes noires continues).
Les chercheurs ont également donné une explication microscopique à un simple, encore sans réponse, question :comment l'eau liquide peut-elle geler en continu en glace cristalline ? Ils ont trouvé des fluctuations dynamiques des domaines microscopiques de l'eau et de la glace près du point critique - une image microscopique de l'eau au cours d'une congélation ou d'une fonte progressive.
Les points critiques dans l'eau confinée sont omniprésents et peuvent être trouvés aux conditions ambiantes en ajustant le diamètre des pores, et donc l'une des applications potentielles est d'utiliser les fluctuations critiques accordables afin de faciliter les réactions chimiques, changements structurels dans les molécules biologiques, et la formation d'assemblages de biomolécules dans l'eau.
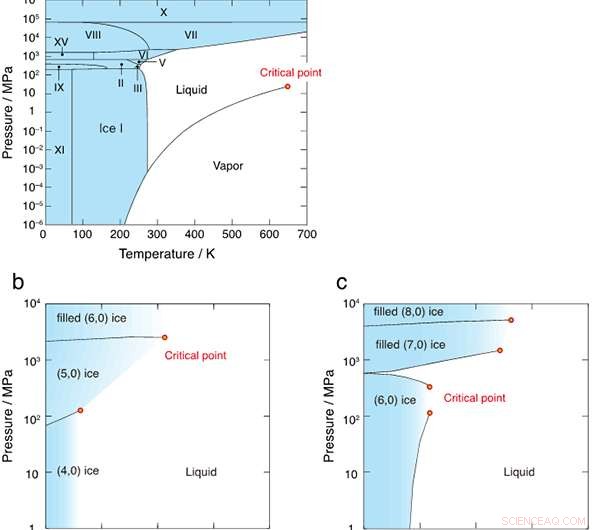
Figure 2 :Diagrammes de phases de (a) eau en vrac, (b) de l'eau confinée dans le nanotube d'un diamètre de 1,11 nm, et (c) 1,25 nm. Les diagrammes de phases de (b) et (c) sont d'abord révélés dans cette étude. Les régions pleines sont colorées en bleu et les points critiques sont indiqués par des cercles rouges.